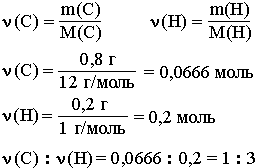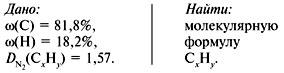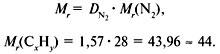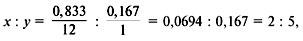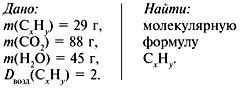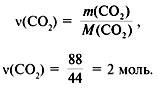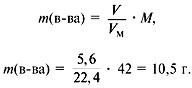- Помогите решить задачи по химии плиз))
- При сжигании углеводорода массой 11, 2г получили 35, 2г C02 и 14, 4 H20?
- Задача 1?
- При сжигании углеводорода массой 2, 1 г получили 6, 6г оксида углерода (IV)?
- При сжигании углеводорода масса выделившегося CO2 в 1, 96 раз больше, чем масса выделившейся воды?
- При сжигании углеводорода массой 29г образовалось 88г оксида углерода(4) и 45 г воды?
- Решить задачу?
- Найти молекулярную формулу углеводорода, если при сжигании 1, 6г этого углеводорода было получено 4, 4г СО2 и 3, 6г Н2О?
- При сжигании углеводорода массой 8, 4 грамма получено 26, 4 грамма газа и 10, 8 грамм воды?
- При сжигании 8, 6 г углеводорода получили 26, 4 г оксида углерода (IV) и 12, 6 г воды?
- При сжигании углеводорода массой 6, 21 получили углекислый газ массой 18, 85 и воды массой 9, 64 г?
- На сжигание некоторого углеводорода понадобился углеводород химическим количеством 0, 16 моль и затратили кислород объёмом 16, 128 дм кубических?
- Вывести формулу углеводорода массой 11 2
- Алгоритм решения задач на нахождение молекулярной формулы газообразного углеводорода
- Просмотр содержимого документа «Алгоритм решения задач на нахождение молекулярной формулы газообразного углеводорода»
Помогите решить задачи по химии плиз))
При сгорании 11,2 г. Углеводорода получили оксид углерода массой 35,2 г и воду массой 14,4 г. Относительная плотность этого углеводорода по воздуху равна 1,93. Выведите молекулярную формулу.
Задача 2. При сжигании 2.2 г. вещества получили 4,4 г оксида углерода и 1,8 г. воды. Относительная плотность вещества по водороду равна 44. Определите молекулярную формулу вещества.
Задача 3. Выведите формулу вещества, содержащего 81,8% углерода и 18,2 % водорода, если относительная плотность по водороду равна 22.
Задача 4. Определите молекулярную формулу углеводорода, если массовая доля углерода равна 85,75, а водорода –14,3%. Относительная плотность этого вещества по азоту примерно равна 2.
Задача 1.
1/ 35, 5г —————х (С) г
44 г/моль ——-12 г
m (C) = 9,6г
14,4г —————у (Н) г
18 г/моль ——-2г/моль
m(Н) = 1,6 г
2/ 9,6 + 1,6 = 11,2 (углеводород состоит из СхНу)
3/ находим количество: n (C) = 9,6/12=0,8 n(H)=1,6/1= 1,6
соотношение С: Н = 0,8:1,6 = 1:2
простешая формула УВ —СН2
4/ Мr(CH2)=14
5/ М =1,93*29= 56
6/ 56:14=4 (СnH2n)
7/ C4H8
Задача 2.
M = 2*44 = 88г/моль
n CO2 = 4.4/44 = 0.1 моль
n H2O = 1.8/18 = 0.1 моль
n CxHyOz = 2.2/88 = 0.025 моль
Следовательно
Из 1 моля вещества получиться 4 моля СО2 и 4 моля Н2О
Из этого следует, что х = 4, y = 8
12*4 + 8 = 56
z = (88-56)/16 = 2
CxHyOz = C4H4O2
Задача 3.
1. М= 22 * 2 = 44;
2. 44 —-100%
х —-81,8
х=36
3. 36:12=3 С
44 — 36 = 8 Н
4. 8:1=8
5. С3Н8 — пропан
Задача 4.
1. М = 2*28 = 56
2. 56 —-100%
х ——-85,75
х = 48
3. 48 :12 = 4 C
4. 56-48 = 8 H
5. C4H8
Источник
При сжигании углеводорода массой 11, 2г получили 35, 2г C02 и 14, 4 H20?
Химия | 10 — 11 классы
При сжигании углеводорода массой 11, 2г получили 35, 2г C02 и 14, 4 H20.
Найти молекулярную формулу.
2 г : 44г / моль = 0, 8 моль
n(H) = 2n(H2O) = 2 * (14.
4 г : 18 г / моль) = 1, 6 моль
n(C) : n (H) как 1 : 2
Простейшая формула : СН2
Задача 1?
2г углеводорода образуется 8, 8г СО2.
Относительная плотность по водороду этого вещества равна 8.
Найдите формулу углеводорода.
При сжигании углеводорода массой 2, 1 г получили 6, 6г оксида углерода (IV).
Относительная плотность органического соединения по водороду равна 42.
Выведите молекулярную формулу углеводорода Задача 3.
При сжигании 4, 4г алкана выделилось 13, 4г углекислого газа.
Относительная плотность вещества по воздуху равна 1, 52.
Определите молекулярную формулу алкана.
При сжигании углеводорода массой 2, 1 г получили 6, 6г оксида углерода (IV)?
При сжигании углеводорода массой 2, 1 г получили 6, 6г оксида углерода (IV).
Относительная плотность органического соединения по водороду равна 42.
Выведите молекулярную формулу углеводорода.
При сжигании углеводорода масса выделившегося CO2 в 1, 96 раз больше, чем масса выделившейся воды?
При сжигании углеводорода масса выделившегося CO2 в 1, 96 раз больше, чем масса выделившейся воды.
Определите формулу углеводорода.
При сжигании углеводорода массой 29г образовалось 88г оксида углерода(4) и 45 г воды?
При сжигании углеводорода массой 29г образовалось 88г оксида углерода(4) и 45 г воды.
Относительная плотность вещества по воздуху 2.
Найти молекулярную формулу углеводорода.
Решить задачу?
А) При сжигании углеводорода массой 3, 2 г образовался оксид углерода (IV) массой 9, 9г и вода массой 4, 5г.
Относительная плотность паров этого вещества по водороду равна 64.
Найдите молекулярную формулу углеводорода.
Б)При сжигании углеводорода объемом 2, 24л образовался оксид углерода (IV) массой 13, 2г и вода массой 7, 2г.
Относительная плотность паров этого вещества по водороду равна 22.
Найдите молекулярную формулу углеводорода.
Найти молекулярную формулу углеводорода, если при сжигании 1, 6г этого углеводорода было получено 4, 4г СО2 и 3, 6г Н2О?
Найти молекулярную формулу углеводорода, если при сжигании 1, 6г этого углеводорода было получено 4, 4г СО2 и 3, 6г Н2О.
Плотность вещества по водороду = 8 Очень — очень нужно решение.
При сжигании углеводорода массой 8, 4 грамма получено 26, 4 грамма газа и 10, 8 грамм воды?
При сжигании углеводорода массой 8, 4 грамма получено 26, 4 грамма газа и 10, 8 грамм воды.
Плотность паров этого вещества по воздуху 2, 9.
Определите молекулярную формулу.
При сжигании 8, 6 г углеводорода получили 26, 4 г оксида углерода (IV) и 12, 6 г воды?
При сжигании 8, 6 г углеводорода получили 26, 4 г оксида углерода (IV) и 12, 6 г воды.
Найдите молекулярную формулу этого углеводорода, если его плотностьпо отношению к воздуху равна 2, 966.
Напишите структурные формулы всех изомеров углеводорода и назовите их.
НАПИШИТЕ ДАНО ЧТО НАЙТИ И РЕШЕНИЕ.
При сжигании углеводорода массой 6, 21 получили углекислый газ массой 18, 85 и воды массой 9, 64 г?
При сжигании углеводорода массой 6, 21 получили углекислый газ массой 18, 85 и воды массой 9, 64 г.
Найти молекулярную формулу вещества, если относительно плотность равна 2.
На сжигание некоторого углеводорода понадобился углеводород химическим количеством 0, 16 моль и затратили кислород объёмом 16, 128 дм кубических?
На сжигание некоторого углеводорода понадобился углеводород химическим количеством 0, 16 моль и затратили кислород объёмом 16, 128 дм кубических.
Найти молекулярную формулу данного углеводорода.
Вы перешли к вопросу При сжигании углеводорода массой 11, 2г получили 35, 2г C02 и 14, 4 H20?. Он относится к категории Химия, для 10 — 11 классов. Здесь размещен ответ по заданным параметрам. Если этот вариант ответа не полностью вас удовлетворяет, то с помощью автоматического умного поиска можно найти другие вопросы по этой же теме, в категории Химия. В случае если ответы на похожие вопросы не раскрывают в полном объеме необходимую информацию, то воспользуйтесь кнопкой в верхней части сайта и сформулируйте свой вопрос иначе. Также на этой странице вы сможете ознакомиться с вариантами ответов пользователей.
CH3COOH + Zn = (CH3COO)2Zn + H2 m(CH3COOH) = m(р — ра) * w = 300 * 0. 25 = 75г n(ch3cooh) = m / M = 75 / 60 = 1. 25 моль n(ch3cooh) = n(h2) = 1. 25моль v(h2) = n * Vm = 1. 25 * 22. 4 = 28л.
M1 р — ра = 150г m2 р — ра = 110г. M в — ва 1 = 150 * 0. 65 = 97. 5г mв — ва 2 = 110 * 0. 25 = 27. 5г. mр — ра = m1 р — ра + m2р — ра = 150 + 110 = 260г mв — ва = m1в — а + m2в — ва = 97. 5 + 27. 5 = 125г. Массовая доля. W = mв — ва / mр — р..
Источник
Вывести формулу углеводорода массой 11 2
I . Вывод формул веществ по массовым долям элементов.
Массовая доля азота в оксиде азота равна 36,84 % . Найти формулу данного оксида.
Установите формулу неорганического соединения, содержащего 20 % магния, 53,33 % кислорода и 26,67 % некоторого элемента.
Массовая доля углерода в углеводороде равна 83,72 %. Найти молекулярную формулу углеводорода.
Массовая доля фосфора в его оксиде равна 43,66 %. Какова формула оксида?
Определить формулу вторичного амина, массовые доли углерода, водорода и азота, в котором составляют 61; 15,3 и 23,7 % соответственно.
Массовая доля углерода в диеновом углеводороде составляет 88,89 %. Найти молекулярную формулу диена.
II . Вывод формул веществ по массовым долям элементов и данным для нахождения истинной молярной массы (плотности, массе и объёму газа или относительной плотности).
Найти формулу углеводорода, в котором содержится 14,29 % водорода, а его относительная плотность по азоту равна 2.
Массовая доля углерода в углеводороде – 87,5 %, а относительная плотность углеводорода по воздуху равна 3,31. Определить формулу вещества.
Определить молекулярную формулу амина, массовые доли углерода, азота и водорода в котором составляют 38,7; 45,15 и 16,15 % соответственно. Относитель-
ная плотность его паров по воздуху равна 1,069.
Определите формулу углеводорода, массовая доля водорода в котором составляет 14,3 %. Относительная плотность этого вещества по водороду равна 21.
Относительная плотность паров углеводорода по воздуху равна 3,31, а массовая доля водорода в нём равна 12,5 %. Определите молекулярную формулу углеводорода.
III . Вывод формул веществ по продуктам сгорания.
При сгорании 7,2 г вещества образовалось 9,9 г углекислого газа и 8,1 г воды. Плотность паров этого вещества по водороду равна 16. Определите молекулярную формулу вещества.
При сгорании газа, не содержащего кислород, выделилось 2,24 л углекислого газа, 1,8 г воды и 3,65 г хлороводорода. Определить формулу сгоревшего вещества.
При сгорании вторичного амина симметричного строения выделилось 0,896 л (н.у.) углекислого газа, 0,99 г воды и 0,112 л (н.у.) азота. Установите молекулярную формулу этого амина.
При полном сгорании органического вещества, не содержащего кислород, выделилось 4,48 л (н.у.) углекислого газа, 1.8 г воды и 4 г фтороводорода. Установите молекулярную формулу сгоревшего соединения.
При сгорании 0,62 г газообразного органического вещества выделилось 0,448 л углекислого газа, 0,9 г воды и 0.224 л азота (объёмы газов измерены при н. у.). Плотность вещества по водороду 15,50. Установите его молекулярную формулу.
IV . Вывод формул органических веществ по общим формулам.
1. Вывод формул по известной массовой доле элемента в веществе.
Определить формулу аминокислоты, если известно, что она содержит 15,73 % азота.
Массовая доля водорода в алкане составляет 0,1579. Найти формулу алкана.
Массовая доля углерода в алкине 87,8 %. Определить формулу алкина.
Массовая доля кислорода в аминокислоте равна 35,95 %. Найти молекулярную формулу аминокислот.
Массовая доля хлора в монохлоралкане равна 55,04 %. Найти формулу моно —
2. Вывод формул по известным данным для нахождения истинной молярной массы
Пары одного из монобромалканов в 68,5 раз тяжелее водорода. Найти формулу монобромалкана.
Плотность газообразного алкина равна 2,41 г/л. Найти его молекулярную формулу.
Относительная плотность паров альдегида по воздуху равна 1,517. Найти его молекулярную формулу.
Относительная плотность паров первичного амина по кислороду – 2,719.
Определить его молекулярную формулу.
Найти молекулярную формулу алкина, если 5,6 л его имеют массу 10 г.
3. Вывод формул по уравнениям реакций в общем виде, если известны данные для двух веществ .
При взаимодействии предельного одноатомного спирта массой 3 г с избытком натрия было получено 0,56 л водорода. Определить формулу спирта.
При взаимодействии 2,9г неизвестного альдегида с аммиачным раствором оксида серебра получается 10,8г металла. Определить формулу альдегида.
В результате реакции предельного одноатомного спирта с 18,25г хлороводорода получили органический продукт массой 46,25г и воду. Определить молекулярную формулу спирта.
Для сжигания 5,8г алкана потребовалось 14,56л (н.у.) кислорода. Определить формулу алкана.
К 10,5г алкена присоединяют 5,6л бромоводорода (н.у.).
Найти формулу алкена.
4. Вывод формул по уравнениям реакций в общем виде с применением закона сохранения массы веществ.
Некоторый сложный эфир массой 7,4г подвергнут щелочному гидролизу. При этом получено 9,8г калиевой соли предельной одноосновной кислоты и 3.2г спирта. Установите формулу этого эфира.
При щелочном гидролизе 37г некоторого сложного эфира получено 49г калиевой соли предельной одноосновной кислоты и 16г спирта. Установить формулу сложного эфира.
Некоторая предельная одноосновная кислота массой 6г прореагировала с 6г спирта, при этом получилось 10,2г сложного эфира. Определить формулу кислоты.
Источник
Алгоритм решения задач на нахождение молекулярной формулы газообразного углеводорода

Алгоритм решения задач на нахождение молекулярной формулы газообразного углеводорода, составлен с помощью разработок по данной теме в Интернет, в помощь обучающимся в 10 классе.
Просмотр содержимого документа
«Алгоритм решения задач на нахождение молекулярной формулы газообразного углеводорода»
Тема: «Решение задач на нахождение молекулярной формулы газообразного углеводорода по его плотности и массовой доле элементов»
закрепить знание понятий «органические вещества», «углеводороды», «массовая доля», «количество вещества», «относительная плотность»;
научить студентов решать задачи на нахождение молекулярной формулы органического вещества;
сформировать умения определять состав органических веществ исходя из знания массовых долей элементов, а также масс или объемов продуктов сгорания этих веществ;
Развивающие: развивать умения анализировать, сравнивать, применять теоретические знания на практике для решения задач;
Воспитательные: способствовать формированию научного мировоззрения.
2. Обеспечение занятия: таблица «Периодическая система», инструкции для студентов, тестовые задания для проверки знаний, карточки задания.
3.1. Разбор алгоритма решения задач.
3.2. Самостоятельное решение заданий.
3.3. Выполнение проверочной работы по вариантам.
4.1. Записать тему и цели практического занятия.
4.2. Привести решение задач.
4.3. Ответы к проверочной работе.
5. Анализ преподавателем выполнения работы.
6. Рекомендуемая литература:
Саенко О. Е. Химия. Учебник для колледжей. Ростов на Дону, 2008.
Габриелян О. С. Химия. Учебник для студентов среднего профессионального образования. –М.:Академия, 2008.
Кузьменко Н.Е., Еремин В.В., Попков В.А. Химия. Для школьников старших классов и поступающих в вузы. – М.: ОНИКС 21 век: Мир и образование, 2002. – С. 177–236.
Вывод формул соединений.
Этот вид расчетов чрезвычайно важен для химической практики, т.к. позволяет на основании экспериментальных данных определить формулу вещества (простейшую и молекулярную). На основании данных качественного и количественного анализов химик находит сначала соотношение атомов в молекуле (или другой структурной единице вещества), т.е. его простейшую формулу.
Например, анализ показал, что вещество является углеводородом CxHy, в котором массовые доли углерода и водорода соответственно равны 0,8 и 0,2 (80% и 20%). Чтобы определить соотношение атомов элементов, достаточно определить их количества вещества (число молей):
Таким образом, CH3 является простейшей формулой данного вещества. Соотношению атомов C и H, равному 1 : 3, соответствует бесчисленное количество формул: C2H6, C3H9, C4H12 и т.д., но из этого ряда только одна формула является молекулярной для данного вещества, т.е. отражающей истинное количество атомов в его молекуле. Чтобы вычислить молекулярную формулу, кроме количественного состава вещества, необходимо знать его молекулярную массу. Для определения этой величины часто используется значение относительной плотности газа D. Так, для вышеприведенного случая DH2 = 15.
Тогда M(CxHy) = 15 M(H2) = 15•2 г/моль = 30 г/моль.
Поскольку M(CH3) = 15, то для соответствия с истинной молекулярной массой необходимо удвоить индексы в формуле. Следовательно, молекулярная формула вещества: C2H6.
Алгоритм 1. Решение расчетных задач на вывод
молекулярной формулы вещества по массовым долям элементов
Задача 1. Найти молекулярную формулу вещества, содержащего 81,8% углерода и 18,2% водорода. Относительная плотность вещества по азоту равна 1,57.
1. Записать условие задачи.
2. Вычислить относительную молекулярную массу Mr(CхHy) по относительной плотности:
3. Найти индексы х и y по отношению 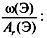
4. Записать простейшую формулу: С3Н8.
Задача 2. Найти молекулярную формулу предельного углеводорода, массовая доля углерода в котором 83,3%.
1. Записать условие задачи.
2. Найти массовую долю водорода:
3. Найти индексы и простейшую формулу для углеводорода CхHy:
следовательно, простейшая формула – C2H5.
4. Найти истинную формулу. Поскольку общая формула алканов СnH2n+2, то истинная формула – С4Н10.
Алгоритм 2. Решение расчетных задач на вывод
молекулярной формулы вещества по массе (объему) продуктов сгорания
Задача 3. При сжигании 29г углеводорода образовалось 88г углекислого газа и 45 г воды, относительная плотность вещества по воздуху равна 2. Найти молекулярную формулу углеводорода.
1. Записать условие задачи.
2. Найти относительную молекулярную массу вещества:
3. Найти количество вещества образовавшегося оксида углерода(IV):
4. Найти количество вещества углерода в сожженном веществе:


5. Найти количество вещества воды:

6. Найти количество вещества водорода в сожженном веществе:



7. Найти простейшую формулу углеводорода:


следовательно, простейшая формула – С2Н5.
8. Найти истинную формулу углеводорода:
следовательно, истинная формула – C4H10.
Задача 4. При сжигании 5,6 л (н.у.) газообразного органического вещества было получено 16,8 л (н.у.) углекислого газа и 13,5 г воды. Масса 1 л исходного вещества при н.у. равна 1,875 г. Найти его молекулярную формулу.
1. Записать условие задачи.
2. Найти молекулярную массу вещества из пропорции:
1 л газа – 1,875 г,
Отсюда m = 42 г, M = 42 г/моль.
3. Найти количество вещества углекислого газа и углерода:


4. Найти количества веществ воды и водорода:


5. Найти сумму масс углерода и водорода:
6. Найти массу сожженного вещества:
Следовательно, вещество содержит только углерод и водород.
7. Найти простейшую формулу углеводорода CхHy:


следовательно, простейшая формула – СН2.
8. Найти истинную формулу углеводорода:
следовательно, истинная формула – С3Н6.
Задачи для самостоятельного решения:
Задача 1. Установите молекулярную формулу монохлоралкана, содержащего 38,38% хлора. Приведите графические формулы и названия всех соединений, отвечающих данной формуле.
Cоставим выражение для расчета массовой доли хлора:
Формула монохлоралкана С4Н9Сl
3. Графические формулы изомеров:
СН3 – СН – СН2Сl 2-метил-1-хлорпропан
СН3 – СCl – СН3 2-метил-2-хлорпропан
Задача 2. Установите молекулярную формулу алкена и продукта взаимодействия его с 1 моль бромоводорода, если это монобромпроизводное имеет относительную плотность по воздуху 4,24. Укажите название исходного алкена и одного его изомера.
Общая формула монобромлканов CnH2n+1Br. Молярная масса монобромлкана М= 12n+2n+1+80=14n+81
Зная относительную плотность вещества по воздуху, находим молярную массу: М=29∙4,24=123г/моль
Из выражения 14n+81=123 n=3
Формула бромалкана С3Н7Br, исходного алкана С3Н6 – пропен. Изомер – циклопропан.
Задача 3. Установите молекулярную формулу алкена, если одно и то же количество его, взаимодействуя с различными галогеноводородами, образует, соответственно, 5,23 г хлорпроизводного или 8,2 г бромпроизводного.
Так как количество вещества алкена одно и то же в обеих реакциях, то количества веществ галогеналканов равны:
3. Из выражения 5,23/14n+36,5=8,2/14n+81 n=3
Задача 4. Установите молекулярную формулу алкена, если известно, что 1,012 л (н.у.) его при взаимодействии с хлором образует 5,09 г дихлорпроизводного.
Находим количество вещества алкена:
По уравнению реакции
Задача 5. При полном сгорании 3,9 г углеводорода образовалось 13,2 г углекислого газа и 2,7 г воды. Плотность паров вещества 3,482г/л. Выведите молекулярную формулу.
Задача 6. При взаимодействии 1,74 г алкана с бромом образовалось 4,11 г монобромпроизводного. Определите молекулярную формулу алкана. Запишите структурные формулы названия возможных изомеров.
Задача 7. При полном сгорании неизвестной массы углеводорода образовалось 4,48 л углекислого газа и 3,6г воды. Относительная плотность вещества по водороду равна 14. Выведите молекулярную формулу углеводорода.
Задача 7. При полном сгорании неизвестной массы углеводорода образовалось 4,48 л углекислого газа и 3,6г воды. Относительная плотность вещества по водороду равна 14. Выведите молекулярную формулу углеводорода.
Задача 6. При взаимодействии 1,74 г алкана с бромом образовалось 4,11 г монобромпроизводного. Определите молекулярную формулу алкана. Запишите структурные формулы названия возможных изомеров.
Задача 5. При полном сгорании 3,9 г углеводорода образовалось 13,2 г углекислого газа и 2,7 г воды. Плотность паров вещества 3,482г/л. Выведите молекулярную формулу.
Задача 1. Установите молекулярную формулу монохлоралкана, содержащего 38,38% хлора. Приведите графические формулы и названия всех соединений, отвечающих данной формуле.
Задача 3. Установите молекулярную формулу алкена, если одно и то же количество его, взаимодействуя с различными галогеноводородами, образует, соответственно, 5,23 г хлорпроизводного или 8,2 г бромпроизводного.
Задача 2. Установите молекулярную формулу алкена и продукта взаимодействия его с 1 моль бромоводорода, если это монобромпроизводное имеет относительную плотность по воздуху 4,24. Укажите название исходного алкена и одного его изомера.
Задача 4. Установите молекулярную формулу алкена, если известно, что 1,012 л (н.у.) его при взаимодействии с хлором образует 5,09 г дихлорпроизводного.
Задача 8. При сжигании 3.2г углеводорода образуется 8,8г СО2. Относительная плотность по водороду этого вещества равна 8. Найдите формулу углеводорода.
Задача 9. При сжигании углеводорода массой 2,1 г получили 6,6г оксида углерода (IV). Относительная плотность органического соединения по водороду равна 42. Выведите молекулярную формулу углеводорода
Задача 10. При сжигании 4,4г алкана выделилось 13,4г углекислого газа. Относительная плотность вещества по воздуху равна 1,52. Определите молекулярную формулу алкана.
Задачи для самостоятельного решения:
Задача 1. Найти молекулярную формулу вещества, содержащего 81,8% углерода и 18,2% водорода. Относительная плотность вещества по азоту равна 1,57.
Задача 2. Найти молекулярную формулу предельного углеводорода, массовая доля углерода в котором 83,3%.
Задача 3. При сжигании 29г углеводорода образовалось 88г углекислого газа и 45 г воды, относительная плотность вещества по воздуху равна 2. Найти молекулярную формулу углеводорода.
Задача 4. При сжигании 5,6 л (н.у.) газообразного органического вещества было получено 16,8 л (н.у.) углекислого газа и 13,5 г воды. Масса 1 л исходного вещества ( при н.у.) равна 1,875 г. Найти его молекулярную формулу.
Задача 5. При сгорании 11,2 г Углеводорода получили оксид углерода массой 35,2 г и воду массой 14,4 г. Относительная плотность этого углеводорода по воздуху равна 1,93. Выведите молекулярную формулу.
Задача 6. При сжигании 2.2 г вещества получили 4,4 г оксида углерода и 1,8 г воды. Относительная плотность вещества по водороду равна 44. Определите молекулярную формулу вещества.
Задача 7. Выведите формулу вещества, содержащего 81,8% углерода и 18,2 % водорода, если относительная плотность по водороду равна 22.
Задача 8. Определите молекулярную формулу углеводорода, если массовая доля углерода равна 85,75, а водорода –14,3%. Относительная плотность этого вещества по азоту примерно равна 2.
Задача 9. Найти формулу вещества, содержащего 85,71% углерода и 14,29% водорода, если относительная плотность паров этого вещества по воздуху равна 1,448.
Задача10. При сгорании 4,3 г Углеводорода получили оксид углерода массой 13,2 г и воду массой 6,3 г. Относительная плотность этого углеводорода по воздуху равна 2,966. Выведите молекулярную формулу.
Задача 11. При сгорании 2,1 г вещества получили оксид углерода массой 6,6 г и воду массой 2,7 г. Относительная плотность этого углеводорода по воздуху равна 2,96. Выведите молекулярную формулу.
Задача 12. При сгорании 8,6 г Углеводорода получили оксид углерода массой 26,4 г и воду массой 12,6 г. Относительная плотность этого углеводорода по воздуху равна 2,966. Выведите молекулярную формулу.
Задача 13. При сжигании 3,9 г органического вещества плотность паров по водороду- 39, образовалось 13,2 г углекислого газа и 2,7 г воды. Определить формулу вещества .
Задача 14. При сжигании алкена массой 11,2 г получили 35,2 г оксида углерода (IV) и 14,4 г воды. Относительная плотность алкена по воздуху равна 1,93. Найти молекулярную формулу алкена.
Задача 15. Определить молекулярную формулу углеводорода, если при сжигании 2,2 г его было получено 3,36л углекислого газа и 3,6 г воды. Плотность вещества по воздуху равна 1,5172.
Задача 16. Определить молекулярную формулу углеводорода, если при сжигании 1,3 г его было получено 2,24л углекислого газа и 0,9 г воды. Плотность вещества по водороду равна 12,992.
Задача 17. При сжигании 5,25 г газообразного углеводорода с плотностью по водороду =21 получили 8,4 л углекислого газа и 6,75 г воды. Определить формулу вещества.
Задача 18. Найти молекулярную формулу углеводорода, имеющего плотность по водороду =22. если при сгорании 4,4 г его образуется 6,72л CO2 и 7,2 г Н2О.
Задача 19. Относительная плотность по водороду некоторого алкана 15. Определите его формулу.
Задача 20. Массовая доля углерода в алкане составляет 84%. Определите его формулу.
Задача 21. При сгорании 2,2 г органического вещества, имеющего плотность по воздуху 1,517, образовалось 3,36 л углекислого газа (н.у.) и 3,6 г воды. Определите формулу органического вещества.
Задача 22. Органическое вещество содержит углерод (массовая доля 84,21%) и водород (15,79%). Плотность паров вещества по воздуху составляет 3,93. Определите формулу органического вещества.
Задача 23. Массовая доля углерода в углеводороде составляет 83,33%. плотность паров по водороду =36. Определите формулу углеводорода. Сколько он имеет изомеров? Напишите структурные формулы этих изомеров и назовите их.
Задача 24. Определите формулу предельного одноатомного спирта, если при дегидратации образца его объемом 37 мл и плотностью 1,4 г/мл получили алкен 39,2 г.
Задача 25. Определите молекулярную формулу предельного трехатомного спирта, массовая доля углерода в котором равна массовой доле кислорода.
Источник