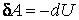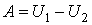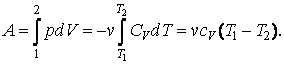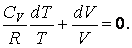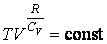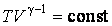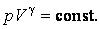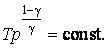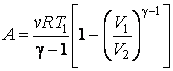- Савельев И.В. Курс общей физики, том I
- Титульный лист
- Предисловие к четвертому изданию
- Из предисловия к четвертому изданию
- Адиабатический процесс и уравнения адиабаты для идеального газа. Пример задачи
- Кратко об идеальном газе
- Что это адиабатический процесс?
- Уравнения Пуассона для адиабатического процесса
- Пример задачи
- Уравнение Пуассона для адиабатного процесса
- Описание адиабатного процесса
- Уравнение Пуассона
- Коэффициент Пуассона
- Применение уравнения в расчетах ДВС и холодильных установок
- 19.Адиабатный процесс. Уравнение адиабаты (вывод).
Савельев И.В. Курс общей физики, том I

Загрузить всю книгу 

Титульный лист
Главная редакция физико-математической литературы
Механика, колебания и волны,
КУРС ОБЩЕЙ ФИЗИКИ, ТОМ I
Главная цель книги — познакомить студентов прежде всего с основными идеями и методами физики. Особое внимание обращено на разъяснение смысли физических законов и на сознательное применение их. Несмотря на сравнительно небольшой объем, книга представляет собой серьезное руководство, обеспечивающее подготовку, достаточную для успешного усвоения в дальнейшем теоретической физики и других физических дисциплин.
Предисловие к четвертому изданию
При подготовке к настоящему изданию книга была значительно переработана. Написаны заново (полностью или частично) параграфы 7, 17, 18, 22, 27, 33, 36, 37, 40, 43, 68, 88. Существенные добавления или изменения сделаны в параграфах 2, 11, 81, 89, 104, 113.
Ранее, при подготовке ко второму и третьему изданиям были написаны заново параграфы 14, 73, 75. Существенные изменения или добавления были внесены в параграфы 109, 114, 133, 143.
Таким образом, по сравнению с первым изданием облик первого тома заметно изменился. Эти изменения отражают методический опыт, накопленный автором последние десять лет преподавания обшей физики в Московском инженерно-физическом институте.
Ноябрь 1969 г. И. Савельев
Из предисловия к четвертому изданию
Предлагаемая вниманию читателей книга представляет собой первый том учебного пособия по курсу общей физики для втузов. Автор в течение ряда лет преподавал общую физику в Московском инженерно-физическом институте. Естественно поэтому, что пособие он писал имея в виду прежде всего студентов инженерно-физических специальностей втузов.
При написании книги автор стремился познакомить учащихся с основными идеями и методами физической науки, научить их физически мыслить. Поэтому книга не является по своему характеру энциклопедичной, содержание в основном посвящено тому, чтобы разъяснить смысл физических законов и научить сознательно применять их. Не осведомленности читателя по максимально широкому кругу вопросов, а глубоких знаний фундаментальным основам физической пауки — вот что стремился добиться автор.
Источник
Адиабатический процесс и уравнения адиабаты для идеального газа. Пример задачи
Адиабатический переход между двумя состояниями в газах не относится к числу изопроцессов, тем не менее, он играет важную роль не только в различных технологических процессах, но и в природе. В данной статье рассмотрим, что представляет собой этот процесс, а также приведем уравнения адиабаты идеального газа.
Кратко об идеальном газе
Идеальным называется такой газ, в котором нет взаимодействий между его частицами, и их размеры равны нулю. В природе, конечно же, не существует идеальных на сто процентов газов, поскольку все они состоят из имеющих размеры молекул и атомов, которые взаимодействуют друг с другом всегда как минимум с помощью ван-дер-ваальсовых сил. Тем не менее, описанная модель часто выполняется с достаточной для решения практических задач точностью для многих реальных газов.

Главным уравнением идеального газа является закон Клапейрона-Менделеева. Он записывается в следующей форме:
Это уравнение устанавливает прямую пропорциональность между произведением давления P на объем V и количества вещества n на абсолютную температуру T. Величина R — газовая константа, которая играет роль коэффициента пропорциональности.
Что это адиабатический процесс?
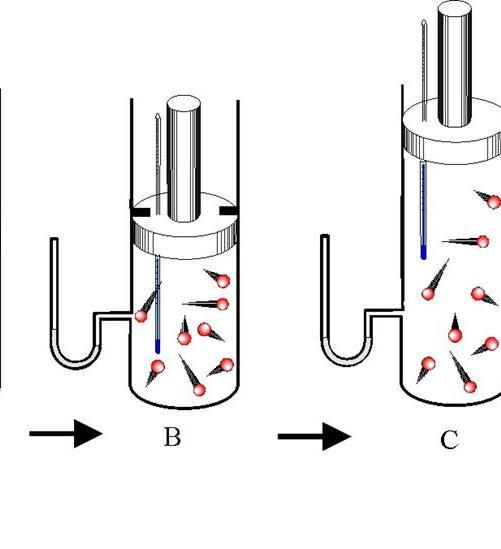
Адиабатический процесс — это такой переход между состояниями газовой системы, при котором обмена энергией с внешней средой не происходит. При этом изменяются все три термодинамических характеристики системы (P, V, T), а количество вещества n остается постоянным.
Различают адиабатическое расширение и сжатие. Оба процесса происходят только за счет внутренней энергии системы. Так, в результате расширения давление и особенно температура системы сильно падают. Наоборот, адиабатическое сжатие приводит к положительному скачку температуры и давления.
Чтобы не происходил обмен теплом между окружающей средой и системой, последняя должна обладать теплоизолированными стенками. Кроме того, сокращение длительности протекания процесса значительно уменьшает тепловой поток от и к системе.
Уравнения Пуассона для адиабатического процесса
Первый закон термодинамики записывается в таком виде:
Иными словами, сообщенная системе теплота Q идет на выполнение системой работы A и на повышение ее энергии внутренней ΔU. Чтобы написать уравнение адиабаты, следует положить Q=0, что соответствует определению изучаемого процесса. Получаем:
При изохорном процессе в идеальном газе все тепло идет на повышение внутренней энергии. Этот факт позволяет записать равенство:
Где CV — изохорная теплоемкость. Работа A, в свою очередь, вычисляется так:
Где dV — малое изменение объема.
Помимо уравнения Клапейрона-Менделеева, для идеального газа справедливо следующее равенство:
Где CP — изобарная теплоемкость, которая всегда больше изохорной, так как она учитывает потери газа на расширение.
Анализируя записанные выше равенства и проводя интегрирование по температуре и объему, приходим к следующему уравнению адиабаты:
Здесь γ — это показатель адиабаты. Он равен отношению изобарной теплоемкости к изохорной. Это равенство называется уравнением Пуассона для процесса адиабатического. Применяя закон Клапейрона-Менделеева, можно записать еще два аналогичных выражения, только уже через параметры P-T и P-V:
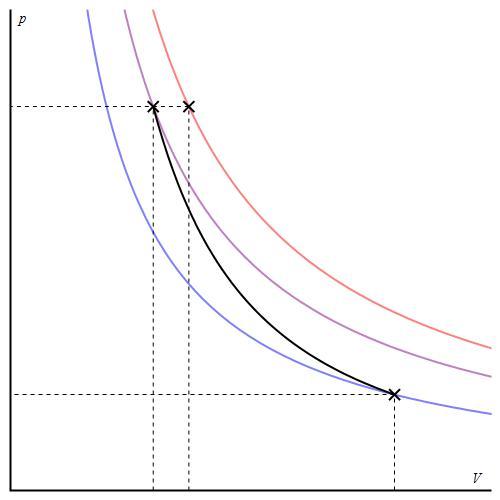
График адиабаты можно привести в различных осях. Ниже он показан в осях P-V.
Цветные линии на графике соответствуют изотермам, черная кривая — это адиабата. Как видно, адиабата ведет себя более резко, чем любая из изотерм. Этот факт просто объяснить: для изотермы давление меняется обратно пропорционально объему, для изобаты же давление изменяется быстрее, поскольку показатель γ>1 для любой газовой системы.
Пример задачи
В природе в горной местности, когда воздушная масса движется вверх по склону, то ее давление падает, она увеличивается в объеме и охлаждается. Этот адиабатический процесс приводит к снижению точки росы и к образованию жидких и твердых осадков.
Предлагается решить следующую задачу: в процессе подъема воздушной массы по склону горы давление упало на 30 % по сравнению с давлением у подножия. Чему стала равна ее температура, если у подножия она составляла 25 oC?
Для решения задачи следует использовать следующее уравнение адиабаты:
Его лучше записать в таком виде:
Если P1 принять за 1 атмосферу, то P2 будет равно 0,7 атмосферы. Для воздуха показатель адиабаты равен 1,4, поскольку его можно считать двухатомным идеальным газом. Значение температуры T1 равно 298,15 К. Подставляя все эти числа в выражение выше, получаем T2 = 269,26 К, что соответствует -3,9 oC.
Источник
Уравнение Пуассона для адиабатного процесса
Описание адиабатного процесса
Адиабатный или адиабатический процесс – это процесс, который протекает с небольшой скоростью при отсутствии теплового обмена с окружающей средой.
Адиабатный процесс является разновидностью термодинамического процесса. Важными условиями его возникновения являются теплоизолированная система и условия, при которых полностью исключается теплообмен с окружающей средой. При проведении практических исследований Q = 0. По первому закону термодинамики требуется полный расход выполненной работы для изменения внутренней энергии системы:
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут.
Такие результаты практически недостижимы при реальных условиях. Причина заключается в отсутствии идеальных теплоизоляционных материалов. Однако ученым удалось максимально приблизиться к созданию подходящих условий.
Например, благодаря применению оболочек, которые характеризуются низкими параметрами теплопроводности, создаются условия, как в термосе. Другим способом выступает достижение достаточно большой скорости протекания адиабатного процесса. В этом случае система обменивается теплом с окружающей средой в течение короткого промежутка времени, которым можно пренебречь при расчетах.
Уравнение Пуассона
При возникновении адиабатного процесса наблюдается одновременное изменение трех характеристик, которыми обладает газообразное вещество: V, p, Т. Величины зависят друг от друга, что выражается в уравнении Клапейрона-Менделеева. Корректно представить описание процесса можно, дополняя формулу уравнением Пуассона.
Формулировка отражает наличие зависимости между объемом и давлением газа. Исходя из первого принципа термодинамики, уравнение для адиабатного процесса в случае идеального газа будет выглядеть следующим образом:
Удаляя из уравнения выражение dT по уравнению Клапейрона-Менделеева, получается следующее равенство:
\(dT=\frac<1>
В результате будет записана формула:
Исходя из уравнения Майера,
Необходимо подставить эту формулу, а также поделить числитель и знаменатель дроби перед скобками на \(CV\) и обозначить \(CP/CV\) – \(\gamma\)
Можно сделать следующий вывод:
\(V dp + \gamma pdV=0\)
Почленно поделив уравнение на произведение \(pV\) , формула будет записана следующим образом:
В результате интеграции данного уравнения получается следующее соотношение:
\(\ln p+\gamma \ln V=\ln C\)
где С является постоянной величиной интегрирования.
Если пропотенциировать последнюю формулу, то в итоге получается уравнение Пуссона:
Важно отметить, что \(\gamma\) определяется природой газообразного вещества. К примеру, в случае воздуха \(\gamma=1,42\) .
Коэффициент Пуассона
Показатель адиабаты равен отношению теплоемкости в условиях постоянного давления к теплоемкости в условиях постоянного объема.
Показатель адиабаты по-другому называют коэффициентом Пуассона или фактором изоэнтропийного расширения. Для обозначения этой величины используют греческую букву γ (гамма) или κ (каппа). Такие специальные символы применимы для решения задач химических инженерных дисциплин. Если решается задача по теплотехнике, целесообразно изображать коэффициент Пуассона в виде латинской буквы k.
Показатель адиабаты рассчитывают из отношения между изобарной теплоемкостью газообразного вещества и его изохорной теплоемкостью. Формула имеет следующий вид:
В разных газах показатель адиабаты будет неодинаковым. Для идеального газообразного вещества коэффициент Пуассона составляет 5/3, для двухатомного – 7/3, для трехатомного – 4/3.
Применение уравнения в расчетах ДВС и холодильных установок
В условиях реальных газов имеют значения силы, которые возникают при взаимодействии молекул друг с другом. Для расчета показателя адиабаты исследованных газообразных веществ требуется проводить эксперименты. В 1819 году учеными Клеманом и Дезормом были предложены методики определения коэффициента Пуассона. Описание эксперимента:
- резервуар наполнили охлажденным газом;
- достижение давлением величины Р1;
- открытие крана;
- адиабатическое расширение газа;
- понижение давления до значения атмосферного РА;
- изохорное прогревание газообразного вещества до температуры окружающей среды;
- повышение давления в баллоне до Р2.
В этом случае показатель адиабаты будет иметь следующий вид:
После расчетов показатель адиабаты будет больше 1. Это объясняет постоянное возрастание температуры во время адиабатического сжатия идеального или реального газа. В случае расширения газообразного вещества, температурные показатели снижаются. Описанное явление носит название пневматического огнива. Это свойство адиабатического процесса применяют при конструировании двигателей, функционирующих на дизельном топливе. Горючая смесь в агрегате сжимается, находясь в специальном цилиндре, и воспламеняется под действием высокой температуры.
Уравнение Пуассона применимо не только для разработки двигателей внутреннего сгорания, но и активно применяется для осуществления расчетов в проектировании холодильного оборудования. Формула Пуассона позволяет с максимальной точностью описать равновесный адиабатный процесс, при условии которого состояния равновесия непрерывно сменяют друг друга. Если в реальных обстоятельствах открыть кран в баллоне, что приведет к адиабатному расширению газа, можно будет наблюдать нестационарный переходный процесс, сопровождающийся завихрениями газообразного вещества, которые со временем затухают по причине макроскопического трения.
Источник
19.Адиабатный процесс. Уравнение адиабаты (вывод).
Адиабатным называют такой процесс, в котором к системе не подво-дится тепло и от системы не отводится тепло. При адиабатном процессе должна быть обеспечена идеальная теплоизоляция от внешней среды, в отличие от изотермического процесса, требующего идеального теплового контакта со средой. В реальных условиях процесс является адиабатным, если система снабжена хорошей теплоизоляцией или если процесс протекает настолько быстро, что не происходит заметного теплообмена с внешней средой.
Из первого закона термодинамики следует, что при адиабатном процессе 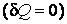
Можно записать и в интегральной форме:
Если вещество расширяется и совершает работу над внешними телами, то 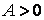
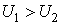
Для идеального газа:
Отсюда видно, что при адиабатном расширении 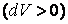
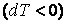

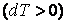
Проинтегрировав, найдем работу, совершаемую идеальным газом при адиабатном процессе.
Теплоемкость 
Чтобы найти уравнение адиабаты в переменных 
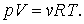
Интегрирование последнего соотношения дает
Выразим величину 


Последнее соотношение есть уравнение адиабаты (уравнение Пуассона) в переменных T,V. Чтобы записать это уравнение в координатах p,V или T,p нужно произвести замену соответствующих переменных , воспользовавшись уравнением Менделеева – Клапейрона. В результате получим еще два эквивалентных уравнения адиабаты:
Выражение для работы можно записать иначе. Для этого уравнение адиабаты представим в виде:
Подставляя, и учитывая что 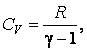
Из уравнения Пуассона (4.9.9) следует, что давление идеального газа в адиабатном процессе 
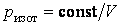
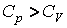
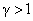



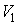
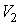

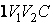
Наоборот, при адиабатном сжатии от объема до объема 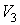
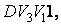

21 ПОЛИТРОПНЫЕ ПРОЦЕССЫ. УРАВНЕНИЕ ПОЛИТРОПНЫ (ВЫВОД).
Политропический процесс — термодинамический процесс, во время которого удельная теплоёмкость c газа остаётся неизменной. Предельными частными явлениями политропного процесса являются изотермический процесс и адиабатный процесс. В случае идеального газа изобарный процесс и изохорный процесс также являются политропическими.
Для идеального газа уравнение политропы может быть записано в виде:
где величина 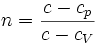
В зависимости от процесса можно определить значение n:
1. Изотермический процесс: n = 1, так как PV1 = const, значит PV = const, значит T = const.
2. Изобарный процесс: n = 0, так как PV0 = P = const.
3. Адиабатный процесс: n = γ, это следует из уравнения Пуассона.
4. Изохорный процесс: 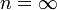

Источник