- Уксусный ангидрид
- Синтез
- Использование
- См. также
- Полезное
- Смотреть что такое «Уксусный ангидрид» в других словарях:
- Уксусный ангидрид (CH3CO)2O легко взаимодействует с водой, образуя уксусную кислоту: (CH3CO)2O + H2O = 2CH3COOH. Какой
- Ответ или решение 1
- Выведите формулы кислот следующих ангидридов ch3co 2o
- Acetyl
Уксусный ангидрид
| Уксусный ангидрид | |
 | |
 | |
| Общие | |
|---|---|
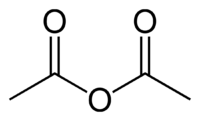
| Химическая формула | C4H6O3 |
| Физические свойства | |
| Состояние (ст. усл.) | жидкость |
| Молярная масса | 102,09 г/моль |
| Плотность | 1,082 г/см³ |
| Термические свойства | |
| Температура плавления | −73,1 °C |
| Температура кипения | 139,8 °C |
| Оптические свойства | |
| Показатель преломления | 1,3902 |
| Классификация | |
| Рег. номер CAS | 108-24-7 |
| SMILES | CC(=O)OC(C)=O |
У́ксусный ангидри́д (ангидри́д у́ксусной кислоты́), (CH3CO)2O, бесцветная с резким запахом жидкость, растворимая в бензоле, эфире и др. органических растворителях; tкип 139,5°С, плотность 1,082 г/см 3 (20°С). В 100 граммах холодной воды растворяется примерно 14 граммов уксусного ангидрида, который медленно реагирует с водой, образуя уксусную кислоту; при нагревании реакция ускоряется.
Синтез
Уксусный ангидрид получается общими для всех ангидридов карбоновых кислот методами. Например:
- реакцией ацетилхлорида с безводным ацетатом натрия (калия, кальция и т.д.)
- реакцией сульфурилхлорида с безводным ацетатом натрия
- реакцией тионилхлорида с безводным ацетатом натрия
POCl3 + 4CHЗCOONa = 2(CHЗCO)2O + NaPO3 + 3NaCl
- взаимодействием трихлорида фосфора с ледяной уксусной кислотой и последующей реакцией получившегося ацетилхлорида с безводным ацетатом натрия
- взаимодействием пентахлорида фосфора с ледяной уксусной кислотой и последующими реакциями получившигся ацетилхлорида и хлорокиси фосфора с безводным ацетатом натрия
POCl3 + 4CHЗCOONa = 2(CHЗCO)2O + NaPO3 + 3NaCl
- взаимодействием хлорида кремния с безводным ацетатом натрия
- взаимодействием трихлорида бора с ледяной уксусной кислотой и последующей реакцией получившегося ацетилхлорида с безводным ацетатом натрия
- пропусканием фосгена в ледяную уксусную кислоту и последующей реакцией получившегося ацетилхлорида с безводным ацетатом натрия
- реакцией ацетилбромида с безводным ацетатом натрия
- нагреванием смеси безводных натриевых солей хлорсульфоновой и уксусной кислот
- реакцией двухлористой серы C безводным ацетатом натрия
- пропусканием сухого хлора в смесь безводного ацетата натрия и серы, смоченных уксусным ангидридом
- или реакцией безводного ацетата натрия с раствором серы в броме без растворителя
- пропусканием ацетилена в ледяную уксусную кислоту при 70-85 град. цел. в присутствии катализатора сульфата ртути (1% от массы уксусной кислоты взятой в реакцию) с последующим разложением образовавшегося этилидендиацетата на уксусный ангидрид и ацетальдегид
- пропусканием кетена в ледяную уксусную кислоту
- в промышленности уксусный ангидрид получают прямой дегидратацией ледяной уксусной кислоты в присутствии катализаторов, например триэтилфосфата PO(OC2H5)3
- любительский способ: смесь безводных ацетата натрия и сульфата алюминия прокаливается до плавления первого:
образующийся в ходе реакции ацетат алюминия, под действием температуры разлагается на уксусный ангидрид и оксид алюминия:
Использование
- Используется в органическом синтезе в качестве ацилирующего и водоотнимающего агента.
- Является прекурсором в производстве героина и других наркотиков опийной группы, в связи с чем оборот уксусного ангидрида в РФ, Белоруссии, Украине и в некоторых других государствах законодательно ограничен.
См. также
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое «Уксусный ангидрид» в других словарях:
УКСУСНЫЙ АНГИДРИД — (СН3СО)2О, бесцветная с резким запахом жидкость, tкип 139,9 .С. Применяют для ацилирования, напр. в производстве ацетилцеллюлозы, душистых и лекарственных веществ … Большой Энциклопедический словарь
УКСУСНЫЙ АНГИДРИД — (СН3С0)20 бесцветная жидкость с резким запахом, tK 1ш= 139,9°С; получают нагреванием паров уксусной (см.) при 700°С в присутствии катализатора; применяют главным образом в производстве ацетилцеллюлозы, при синтезе аспирина, душистых и… … Большая политехническая энциклопедия
уксусный ангидрид — (СН3СО)2О, бесцветная с резким запахом жидкость, tкип 139,6°C. Применяют для ацилирования, например в производстве ацетилцеллюлозы, душистых и лекарственных веществ. * * * УКСУСНЫЙ АНГИДРИД УКСУСНЫЙ АНГИДРИД, (СН3СО)2О, бесцветная с резким… … Энциклопедический словарь
уксусный ангидрид — acetanhidridas statusas T sritis chemija formulė (CH₃CO)₂O atitikmenys: angl. acetic anhydride rus. ацетангидрид; уксусный ангидрид ryšiai: sinonimas – acto rūgšties anhidridas sinonimas – etano rūgšties anhidridas … Chemijos terminų aiškinamasis žodynas
Уксусный ангидрид — ангидрид уксусной кислоты, (CH3CO)2O, бесцветная с резким запахом жидкость, растворимая в бензоле, эфире и др. органических растворителях; tkип 139,5 °С, плотность 1,082 г/см3 (20 °С). У. а. один из реагентов, широко применяемых в… … Большая советская энциклопедия
УКСУСНЫЙ АНГИДРИД — ангидрид уксусной кислоты, (CH3CO)2O бесцветная жидкость с резким запахом; tnл 139,9 °С. Применяется для введения группы СН3СО (ацетилирования) при получении ацетата целлюлозы, душистых и лекарств. в в, красителей и др … Большой энциклопедический политехнический словарь
Уксусный ангидрид — C4H6O3 = (СН3CO)2О является представителем ангидридов органических жирных кислот формулы СnН2nО2. Он может быть получен в небольших количествах при действии фосфорного ангидрида на уксусную кислоту (Этар, Гал). Обыкновенно его получают так: при… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
УКСУСНЫЙ АНГИДРИД — (СН3СО)2О, бесцв. с резким запахом жидкость, tкип 139,6 °С. Применяют для ацилирования, напр. в произ ве ацетилцеллюлозы, душистых и лекарств. в в … Естествознание. Энциклопедический словарь
Ангидрид — Ангидриды в неорганической химии солеобразующие оксиды, проявляющие кислотные свойства (см. Кислотные оксиды). Ангидриды в органической химии соединения, состоящие из двух кислотных остатков (например, карбоновых или фосфиновых… … Википедия
УКСУСНЫЙ АЛЬДЕГИД — то же, что ацеталъдегид. УКСУСНЫЙ АНГИДРИД (CH3CO)2O, мол. м. 102,09; бесцв. прозрачная подвижная жидкость с резким запахом; т. пл. 73,1 X т. кип. 139,60C: 1,0820; 1,3906; t крит 295,8 0C, р криг 4,6 МПа; 0,901 мПа … Химическая энциклопедия
Источник
Уксусный ангидрид (CH3CO)2O легко взаимодействует с водой, образуя уксусную кислоту: (CH3CO)2O + H2O = 2CH3COOH. Какой
Ответ или решение 1
Найдем массу уксусной кислоты и уксусного ангидрида в 100 г раствора: m((CH3CO)2O) = m(р-ра)*w,
где m(р-ра) – масса раствора, w – содержание уксусного ангидрида в растворе.
Отсюда m((СH3CO)2O) = 100 *0,35 = 35 г.
Тогда масса уксусной кислоты в этом растворе m(CH3COOH)р.анг = m(р-ра)-m((CH3CO)2O) = 100 – 35 = 65 г.
При добавлении к раствору уксусного ангидрида в уксусной кислоте водного раствора уксусной кислоты пройдет реакция уксусного ангидрида с водой, приведенная в условии задачи. Из этого уравнения видно, что из 1 моль уксусного ангидрида образуется 2 моль уксусной кислоты.
Чтобы узнать содержание уксусной кислоты в конечном растворе нужно воспользоваться формулой: w(укс) = (m(укс) + m(СH3COOH)р.анг + m(CH3COOH нов)/(m(водн.р-ра)+m(р-ра анг.)
Где m(водн.р-ра) и m(р-ра анг.) – массы водного раствора уксусноу кислоты и раствора ангидрида в уксусной кислоте, m(CH3COOH нов) – масса уксусной кислоты, образовавшейся из ангидрида, m(укс) – масса уксусной кислоты в водном растворе, m(укс) = m(водн.р-ра)*w(водн.р-ра)
Преобразуем формулу: w(укс) = (m(водн.р-ра)*w(водн.р-ра)+ m(СH3COOH)р.анг + m(CH3COOH нов))/(m(водн.р-ра)+m(р-ра анг.). Тогда w(укс)* (m(водн.р-ра)+m(р-ра анг.) )= m(водн.р-ра)*w(водн.р-ра)+ m(СH3COOH)р.анг + m(CH3COOH нов)
w(укс)* m(водн.р-ра)+ w(укс)* m(р-ра анг.)= m(водн.р-ра)*w(водн.р-ра)+ m(СH3COOH)р.анг + m(CH3COOH нов)
w(укс)* m(водн.р-ра) — m(водн.р-ра)*w(водн.р-ра) = m(СH3COOH)р.анг + m(CH3COOH нов) — w(укс)* m(р-ра анг.)
m(водн.р-ра) *(w(укс)- w(водн.р-ра) )= m(СH3COOH)р.анг + m(CH3COOH нов) — w(укс)* m(р-ра анг.)
m(водн.р-ра) = (m(СH3COOH)р.анг + m(CH3COOH нов) — w(укс)* m(р-ра анг.)) /(w(укс)- w(водн.р-ра) )
С учетом того, что имевшийся уксусный ангидрид прореагировал с водой полностью получим количество вещества уксусного ангидрида n((CH3CO)2O) = m((CH3CO)2O)/M((CH3CO)2O) = 35/102 = 0,343 моль, где М((CH3CO)2O)= 102 г/моль – молярная масса уксусного ангидрида.
Отсюда найдем m(CH3COOH нов) = 2*n((CH3CO)2O)* M(CH3COOH) = 41,18 г.
M(CH3COOH) = 60 г/моль – молярная масса уксусной кислоты.
m(водн.р-ра) =( 65 + 41,18 — 0,85*100)/(0,85 – 0,38) = 45,06 г
Найдем объем V(водн. р-ра) = m(водн.р-ра)/p = 45,06/1,05 = 43 см3
Источник
Выведите формулы кислот следующих ангидридов ch3co 2o
Уксусный ангидрид легко взаимодействует с водой, образуя уксусную кислоту:
Какой объём (см 3 ) водного раствора уксусной кислоты с массовой долей 90% (
= 1,06 г/см 3 ) следует добавить к 55 г раствора уксусного ангидрида в уксусной кислоте с массовой долей
45%, чтобы получить 97-процентный водный раствор уксусной кислоты?
В 55 г исходного раствора содержится 0.45 · 55 = 24.75 г ангидрида и 55 — 24.75 = 30.25 г кислоты.
Из 24.75 г ангидрида можно получить 29.12 г кислоты.
Всего из исходного раствора можно получить 30.25 + 29.12 = 59.37 г кислоты.
Пусть х — объем добавленного раствора.
Его масса составит 1.06х г.
В нем содержится 0.9 · 1.06х = 0.954х г кислоты.
После смешивания двух растворов получается новый раствор с массой 55 + 1.06х г,
Источник
Acetyl
Это пилотный ролик из серии об органических реакциях.
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Источник |









