Как убрать красноту после герпеса
Герпес – это вирус, передающийся контактным путем. Он не так безобиден, как многие представляют, ведь сохраняется в теле человека в неактивном состоянии на долгое время. Существует 8 изученных типов вируса, опасных для человека. Сыпь на губах и лице вызывает вирус простого герпеса 1 типа. Болезнь необходимо грамотно лечить, тогда можно будет избежать или минимизировать риск остаточных явлений. Рассмотрим, что делать, если после герпеса остались красные пятна, как избавиться от них с помощью медикаментов и средств народной медицины.
Почему образуются пятна после герпеса на губах и коже
Симптомы болезни – пузырьки, заполненные экссудатом. Воспаление кожи под пузырьками не дает ликвидировать проявления слишком быстро. Наблюдается зуд, жжение кожи, в некоторых случаях – общее недомогание. Рассмотрим первый тип герпеса, локализующийся на губах. При несвоевременном лечении, по завершении рецидива можно заметить, что осталось на губе или теле пациента. Обычно это пятна, шрамы либо рубцы. Причины появления следов от герпеса прозаичны:
- механические травмы образовавшейся корочки;
- неграмотное лечение неподходящими препаратами;
- сознательный прокол пузырьков;
- использование косметических средств во время болезни, чтобы визуально скрыть дефект.
Женщины более щепетильно относятся к собственной внешности, поэтому прилагают усилия, чтобы скрыть шрамы, пятна и рубцы. Появление шрамов – не просто косметический дефект, ведь болезнь периодически будет возобновляться в рецидивирующих проявлениях. Значит, необходимо не только лечить, а нужно позаботиться о дальнейшей профилактике.
После герпеса осталось красное пятно: что делать
Предупреждать появление герпетических дефектов нужно еще во время болезни. В этом помогут специальные медикаменты для контроля вируса. Покраснение не останется на коже, если присоединить к медикаментозному лечению холодовую терапию, косметические процедуры, использовать отвары трав. Рассмотрим подробнее, что делать, чтобы убрать зуд, жжение и покраснение.
Главное, не пропустить первые признаки проявления герпеса, ведь чем раньше будет начата комбинированная терапия, тем легче будет течение всей болезни, а естественная регенерация быстро восстановит кожный покров.
Медикаменты
Проявления герпеса убирают при помощи таблеток – иммуномодулирующих и противовирусных. Они снизят интенсивность покраснения, но только в случае отсутствия аллергии на препараты. Среди таблетированных медикаментов, снижающих покраснения на коже:
- противовирусные – Зовиракс, Ацикловир, Фармвир, Валтрекс;
- иммуномодуляторы – Анаферон, Изопринозин, Галавит.
Мази с ацикловиром представляют собой основное лечение герпеса на губах.

Оставшуюся красноту можно осветлить, комбинируя лекарственные гели, примочки из отваров трав. Справиться с дефектами в месте высыпаний после рецидива помогают мази. Они стимулируют регенерацию кожи либо рассасывают рубцы, иногда даже те, что сформировались ранее. Рассмотрим несколько мазей для примера, ведь они включают те же лекарственные компоненты, что и таблетки. Но другая лекарственная форма помогает быстрее проникать в пораженные участки. Например:
- Виферон – мазь, в которой активный компонент интерферон предотвращает размножение вируса и даже купирует присоединение других инфекций.
- Дерматикс – гелевая структура быстро проникает под кожу, смягчая ее. Противозудный, болеутоляющий, а также противопигментный эффекты подходят на первом этапе лечения рецидива.
- Мазь салициловая – сильный антисептик с отличным отбеливающим эффектом. Противовоспалительное действие помогает предотвратить присоединение сторонних инфекций. Регенерирующее свойство мази быстро восстановит целостность кожного покрова.
Это самые эффективные мази, чтобы ликвидировать пятна и рубцы, устранить шрамы. Хорошо помогают Солкосерил, Актовегин, Д-Пантенол, Левомеколь. Это мази с комбинированным составом и действием. Они обеспечивают заживление, регенерацию, нормализацию клеточного метаболизма, устранение рубцов. Важный эффект – насыщение тканей кислородом для ускорения транспортных процессов внутри клеток. Его обеспечит мазь Актовегин.
Чем поможет косметолог
Есть несколько косметологических процедур, которые помогут справиться с последствиями сыпи за 2-3 дня. Это новые возможности, но прежде чем провести очистку кожи, косметолог обязательно должен направить клиента к дерматологу для сдачи необходимых анализов. Есть два метода, как удалять пятна после герпеса на лице с помощью косметолога:
- Озонотерапия – когда озон вводится внутривенно, он стимулирует весь организм, который начинает более активно бороться с вирусом. Есть несколько обязательных условий для лечения озоном, среди них – определение правильной дозировки средства, количество сеансов озонотерапии, дополнительное лечение.
- Убрать красные пятна помогает лазеротерапия – излучение определенной длины очень точно отшелушивает отмершие клетки.
- Иногда проводят процедуру микродермабразии – разновидности пилинга.
Все процедуры должен делать дипломированный специалист, сертифицированный и имеющий медицинское образование. Для регенерации поврежденных тканей подходят все три варианта, но совместно они не применяются в силу противопоказаний и глубокого воздействия.
Народные методы
Красные пятна заставляют искать способы, помогающие от них избавиться. На помощь приходят эффективные методы народного лечения. Это маски, настои, лосьоны, примочки, изготовленные из натуральных ингредиентов собственными руками. Лечение герпеса зависит от включения иммунной системы в этот процесс. Активизация собственных сил организма – это первое, чего следует добиться лечением. При лечении рубцов и пятен, особого упоминания заслужили несколько натуральных ингредиентов:
- мед с корицей;
- календула, зверобой, чистотел и ромашка – высушенные травы;
- парафин;
- огурец, картофель, алоэ.
Эффективны домашние маски с участием белой глины или аптечной бодяги. Белая глина подсушивает кожу, осветляет пятна, сужает поры, уменьшает шрамирование и образование рубцов.
Локальные аппликации тоже довольно действенны. Для них:
- парафин растопите;
- охладите до комнатной температуры;
- нанесите на рубец или шрам.
Теплый состав улучшит кровоток, активирует метаболизм клеток, повысит рассасываемость рубцов. Сам парафин должен быть аптечным, очищенным и подготовленным. Рекомендуется 10 процедур, по 20 минут каждая, чтобы избавиться от дефектов после герпеса.
Травы необходимы для компрессов. Нужно сделать из них лечебные отвары, которыми затем протирать кожу. Ромашка, а вернее, ее отвар разливают в закрытые емкости и держат в темном прохладном месте. Зверобой настаивают на водке, а календула подходит в масляном концентрате. Даже прикладывание долек обычного свежего огурца к пятнам поможет осветлить кожу.
Профилактика появления пятен
Чтобы исключить присоединение вторичной инфекции и длительное заживление, следует запомнить, что вскрывать пузырьки нельзя. Кожные дефекты даже не появятся, если вовремя обрабатывать пузырьки антисептиками. Необходимо мыть руки перед тем, как начинать обработку пораженных участков. Желательно постоянно принимать витаминные комплексы для укрепления иммунитета, который, в свою очередь, будет держать вирус внутри организма в спящем состоянии. Все, что способствует укреплению собственных защитных сил организма, можно считать профилактикой герпетических рецидивов – от обливания холодной водой до упорядочивания рациона и умеренных физических нагрузок.
Источник
Актуальные вопросы тяжелой герпетической инфекции у взрослых
В настоящее время неуклонно увеличивается число больных рецидивирующей герпетической инфекцией, вызванной вирусами простого герпеса (ВПГ) 1 и 2 типа различной локализации. Наиболее распространенная локализация у взрослых лиц — аногенитальная и лабиальная
В настоящее время неуклонно увеличивается число больных рецидивирующей герпетической инфекцией, вызванной вирусами простого герпеса (ВПГ) 1 и 2 типа различной локализации. Наиболее распространенная локализация у взрослых лиц — аногенитальная и лабиальная. Многие вопросы патогенеза и терапии тяжелого и крайне-тяжелого течения герпесвирусной инфекции по-прежнему не решены.
Вид ВПГ относится к семейству Herpesviridae, подсемейству L-Herpesviridae, виду ВПГ. Различают два основных типа вируса — ВПГ 1 и ВПГ 2. Инфицирование возможно как одним, так и двумя типами возбудителя. ВПГ способен внедряться в различные клетки организма человека: в клетки кожи, слизистых оболочек урогенитального и желудочно-кишечного трактов (ЖКТ), дыхательных путей, центральной и периферической нервной системы, печени, эндотелия сосудов, а также в клетки крови — лимфоциты и др. [1]. Место постоянного обитания (пожизненного персистирования) ВПГ — паравертебральные сенсорные ганглии. ВПГ передается прямым контактным путем, возможна передача возбудителя контактно-бытовым и вертикальным путем (от матери к плоду), а также трансфузионным и парентеральным путями через инструменты при оперативных вмешательствах, стоматологических процедурах и т. д.
Как известно, большинство людей инфицированы ВПГ. Первичный иммунный ответ на инфекцию протекает латентно или с герпетическими высыпаниями с местной и общей воспалительной реакцией. У лиц с нормальным иммунным ответом размножение (репликация) ВПГ находится под иммунологическим контролем, и рецидивы бывают крайне редко или не возникают в течение всей жизни. В противовирусной защите организма участвуют факторы неспецифической защиты, уничтожающие или блокирующие вирусы: макрофаги и другие клетки-продуценты интерферонов (ИФН) α, β и γ, ряд интерлейкинов (ИЛ) (фактор некроза опухоли (ФНО), ИЛ-6 и др.), естественные киллеры и факторы, формирующие специфический иммунный ответ против конкретного вируса: цитотоксические Т-лимфоциты (ЦТЛ) (CD 8+ Т-лимфоциты) и В-лимфоциты, ответственные за продукцию специфических антител, блокирующих репликацию вируса и расположенные вне клетки вирусы. Для адекватного функционирования этих клеток и поддержания иммунного ответа необходима соответствующая продукция ИФН и ИЛ.
Под влиянием различных экзогенных и эндогенных факторов, повреждающих иммунную систему, возможно ослабление контроля над репликацией вируса и соответственно развитие рецидива. Рецидив ВПГ-инфекции могут спровоцировать другие инфекционные заболевания, переохлаждение, чрезмерная инсоляция, психические или физические стрессы, интоксикации различного генеза, в том числе употребление алкоголя, циклические изменения гормонального статуса (менструации), особенно при дисбалансе уровня гормонов у женщин, резкая смена климатических поясов и др.
При длительной хронической инфекции вирусы оказывают многостороннее неблагоприятное действие на иммунную систему человека. ВПГ прямо повреждают клетки иммунной системы (лимфоциты, макрофаги и естественные киллеры). Синтезируя белки-супрессоры и химерные белки, вирусы угнетают многие реакции иммунитета: ВПГ могут блокировать действие ИФН, нарушать распознавания инфицированных клеток и другие защитные реакции. Кроме того, высокая мутационная активность вирусного генома также способствует ускользанию вируса от иммунологического контроля.
Хроническая, часто рецидивирующая ВПГ-инфекция может провоцировать развитие аутоиммунных состояний (антифосфолипидный синдром, аутоиммунный тиреоидит, аутоиммунные васкулиты и др.). Кроме того, при интеграции ВПГ в генетический аппарат клеток возможна неопластическая трансформация клеток. Так, ВПГ является одним из факторов повышенного риска развития рака тела и шейки матки и других онкологических заболеваний. Также ВПГ-инфекция является одной из ведущих причин самопроизвольных абортов, преждевременных родов, рождения детей с патологией центральной нервной системы и внутренних органов. ВПГИ ассоциирована со многими «болезнями цивилизации» — атеросклерозом, ишемической болезнью сердца у лиц моложе 50 лет и др. Тяжелое течение ВПГИ может быть маркером онкологических заболеваний и СПИДа [7].
В зависимости от числа и выраженности рецидивов, выделяют легкое, среднетяжелое и тяжелое течение болезни (табл. 1).
При тяжелом течении ВПГ-инфекции возможно одновременное появление нескольких очагов поражения (например, в области половых органов, губ, крыльев носа), а также последовательное возникновение высыпаний разной локализации (один рецидив на фоне другого), продолжительность обострения при этом может достигать 16–20 дней. В месте высыпания больные ощущают жар, жжение, боль, напряжение и/или зуд кожи. На инфильтрированной коже появляется группа пузырьков, заполненных прозрачным содержимым. Пузырьки могут сливаться в сплошной многокамерный элемент. Прозрачное их содержимое затем мутнеет. Пузырьки в дальнейшем вскрываются, образуя мелкие эрозии, или подсыхают и превращаются в корочки. Возможно наслоение вторичной бактериальной инфекции. При рецидивах ВПГ часто поражает одни и те же участки кожи. Как правило, при тяжелом течении инфекции значительно ухудшается физическое и психическое состояние больных. У части пациентов в период рецидива увеличиваются или появляются слабость, лихорадка, озноб, миалгии, цефалгии, артралгии, раздражительность, нарушение сна, эмоциональная лабильность, также могут развиваться тяжелые депрессивные состояния, требующие медикаментозной коррекции. По данным органов здравоохранения США, ВПГ-инфекция аногенитальной локализации является примерно в 10% случаев причиной депрессий и суицидов. Тяжелое течение генитальной формы ВПГ-инфекции с частыми рецидивами приводит к нарушению нормальной половой функции пациента, болезнь нередко создает конфликтные ситуации в семье, на работе. Лечение больных с тяжелым течением ВПГ-инфекции представляет собой сложную задачу и должно включать как медикаментозную терапию, так и психологическую адаптацию пациента.
У больных с тяжелой ВПГ-инфекцией в большинстве случаев не наблюдается стойкого и значимого клинического эффекта в ответ на эпизодические курсы комбинированной терапии (противовирусные и иммунотропные средства, общеукрепляющие препараты). Как правило, такие больные меняют много лечебных учреждений в поисках адекватной помощи.
С течением заболевания появляется много побочных реакций на медикаменты или их непереносимость, в ряде случаев развивается устойчивость ВПГ к ацикловиру, ИФН a, другим средствам. Иммуностимуляторы, используемые эмпирически, могут приносить облегчение в период их приема, но во многих случаях они оказываются неэффективными и даже ухудшают клиническое течение болезни. Усугубляются проявления вторичного иммунодефицита, присоединяются другие инфекции, субдепрессивные состояния переходят в стойкие нарушения психики, теряется вера больных в выздоровление, в возможность современной медицины им помочь.
Для разработки современных подходов к лечению и контролю над ВПГ-инфекцией и более углубленного понимания патогенеза заболевания нами было изучено состояние различных звеньев противовирусной защиты и системы цитокинов у больных с тяжелым и крайне тяжелым течением ВПГ-инфекции аногенитальной и лабиальной локализации, а также степень инфицированности (системности заболевания) и частота сочетания с другими герпесвирусными инфекциями.
Обследовано 102 больных, страдающих тяжелой ВПГ-инфекцией более 2 лет (28 мужчин и 74 женщины, средний возраст — 34 ± 1,5 года) и имеющих частоту рецидивов более шести в год.
При этом у 60 больных наблюдалось от 6 до 11 рецидивов ВПГ-инфекции в год, а у 42 больных — от 12 до 20 рецидивов. У большинства пациентов преобладала аногенительная или смешанная локализация герпеса. Средняя длительность тяжелого течения заболевания составила 9,3 ± 1,2 года. Группу контроля составили 32 практически здоровых добровольца (14 мужчин и 18 женщин, средний возраст — 32 ± 1,6 года). Анализ ряда изучаемых параметров включал результаты обследования пациентов с легким течением заболевания (36 человек — 10 мужчин, 26 женщин, средний возраст — 33,4 ± 2,1 года, с частотой рецидивов 2,9 ± 0,8 в год). При рецидивах жалобы больных были характерными. Часто встречались депрессия, раздражительность, снижение памяти и другие нарушения физического и психического состояния и познавательных функций.
У многих больных в анамнезе были указания на повторные курсы противовирусной и/или иммунотропной терапии, оказывавшей неоднозначное влияние: или кратковременное положительное влияние на течение ВПГ-инфекции, или ухудшение и развитие рецидива на фоне или после отмены иммунокоррекции. Такие анамнестические данные отражают тяжесть иммунной недостаточности и неадекватность проводимой эмпирической терапии без оценки иммунного статуса и индивидуального подбора иммунокорректоров, а также восстановительной терапии — иммунореабилитации [5].
При обследовании больных с тяжелым течением ВПГ-инфекции выявлялись многие маркеры вторичного иммунодефицита в виде хронических инфекционно-воспалительных заболеваний различной локализации, со смешанным характером микрофлоры и в большинстве случаев ее устойчивостью к повторным курсам антибиотикотерапии. Из 102 больных хронической ВПГ-инфекцией тяжелого течения выявлены:
- у 86,3% — хронические рецидивирующие заболевания респираторного тракта (хронический фарингит, хронический трахеит, хронический ларингит, хронический бронхит, хронические синуситы, повторные отиты);
- у 88,2% — хронические рецидивирующие заболевания урогенитального тракта смешанного генеза (цистит, уретрит, вульвовагинит, аднексит, сальпингоофорит, простатит);
- у 50–70% — астено-вегетативный и астено-депрессивный синдром, формирование синдрома хронической усталости;
- у 91,2% — дисбактериоз кишечной флоры, хронические воспалительные заболевания ЖКТ (хронический энтероколит, хронический гастродуоденит);
- у 25–30% — кожные псевдоаллергические реакции (кожный зуд, крапивница, дерматит).
Эти данные свидетельствуют о необходимости комплексного подхода к лечению ВПГ-инфекции тяжелого течения с учетом осложнений вторичного иммунодефицита.
Наличие ВПГ-инфекции подтверждали на основании данных анамнеза, клиники, а также выявления дезоксирибонуклеиновой кислоты (ДНК) ВПГ методом полимеразной цепной реакции (ПЦР) в отделяемом из высыпаний. Исследование иммунного статуса включало определение основных субпопуляций лимфоцитов CD3 + , CD4 + , CD8 + , CD72 + , CD16 + , активационных маркеров лимфоцитов главного комплекса гистосовместимости — HLa-DR+, CD11b в периферической крови с помощью моноклональных антител. Также определяли содержание иммуноглобулинов (Ig) a, M, G, циркулирующих иммунных комплексов (ЦИК) в сыворотке крови. Функциональную активность нейтрофилов — продукцию активных форм кислорода, обеспечивающих бактерицидность, определяли по тесту с нитросиним тетразолием (НСТ-тест). Стимулированный НСТ-тест исследовали при инкубации in vitro с культурой Staphylococcus аureus. Интерфероновый статус оценивали по уровню сывороточного ИФН и продукции лейкоцитами ИФН a при стимуляции вирусом болезни Нью-Кастла и ИФН ( при стимуляции фитогемагглютинином. Количественное содержание цитокинов (ИФН α, ИФН γ, ФНО α, ИЛ-1β, ИЛ-2, ИЛ-4 ИЛ-6,) в плазме/сыворотке крови определяли методом иммуноферментного анализа (ИФА) с использованием тест-систем (ProCon, С.-Петербург, и Вектор-Бест, Новосибирск).
Кроме того, проводили ПЦР-исследование биологических материалов на наличие ДНК ВПГ 1 и 2 типа и других вирусов герпес-группы: цитомегаловируса, вируса герпеса человека (ВГЧ) 6 типа, вируса Эпштейна–Барр. Используемые нами программы амплификации позволяли выявлять ДНК вирусов на уровне, соответствующем активной их репликации. Наличие активной репликации вирусов подтверждали полуколичественным ПЦР-исследованием и серологическими тестами.
В результате исследования у больных с тяжелым течением ВПГ-инфекции обнаружены лабораторные признаки вторичного иммунодефицита.
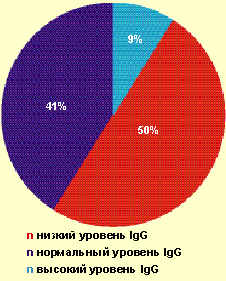 |
| Рисунок 1. Частота выявления различных значений IgG у больных с тяжелым течением ВПГ-инфекции |
Так, у большинства пациентов (91%) отсутствовало адекватное повышение продукции IgG в ответ на рецидив ВПГ-инфекции (рис. 1). При частоте рецидивов ВПГ-инфекции 6–11 рецидивов в год низкий уровень IgG выявлялся у 25% больных, при частоте — 12–20 рецидивов в месяц — уже у 64,3% больных. Более чем у 70% больных был повышен уровень ЦИК в 1,5–2,0 раза от показателей нормы. Известно, что длительная циркуляция ЦИК может приводить к отложению их на эндотелии сосудов и служить одним из факторов формирования аутоиммунной патологии.
У большинства больных с ВПГ-инфекцией тяжелого течения (70%) были обнаружены нарушения в системе естественной и/или специфической цитотоксичности (рис. 2) — снижение содержания зрелых активированных естественных киллеров CD16 + (менее 11%), Т-киллеров и/или ЦТЛ CD8 + (менее 27%). Важно отметить, что выраженное снижение уровня CD8 + (в состав которых входят также и супрессорные клетки) в большинстве случаев сочеталось с повышением уровня CD4 + и иммунорегуляторного индекса, что является фактором риска в отношении формирования аутоиммунных процессов. Как известно, системы естественной и специфической цитотоксичности играют ведущую роль в противовирусной защите.
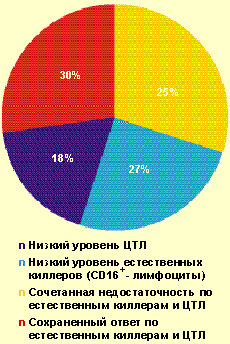 |
| Рисунок 2. Частота выявления нарушений в системе естественной и специфической цитотоксичности у больных с тяжелым течением ВПГ-инфекции (n = 102) |
У больных с тяжелым течением ВПГ-инфекции при рецидиве число естественных киллеров было достоверно ниже нормы и в 2 раза ниже среднего показателя лиц с легким течением заболевания. Почти у половины больных ВПГ-инфекцией выявленные нарушения сочетались с дисиммуноглобулинемией и дефицитом продукции IgG. Уровень HLa-DR + лимфоцитов, отражающих продукцию ИЛ-2 и несущих рецептор DR + , необходимый для распознавания вирус-инфицированных клеток и других реакций иммунитета, был снижен у 39% больных ВПГ-инфекцией (его повышение отмечалось только у 17,4% больных).
Обнаруженные нарушения в системах цитотоксичности и их активационных маркерах при ВПГ-инфекции косвенно свидетельствуют о недостаточном уровне продукции Т-хелперами 1 типа ИЛ-2 — одного из важнейших звеньев цитокиновой сети, необходимого для полноценного противовирусного иммунного ответа.
При исследовании функционального состояния нейтрофилов у больных с тяжелым течением ВПГ-инфекции повышение спонтанного НСТ-теста было выявлено почти в половине случаев. Однако показатели стимулированного НСТ-теста и индекса стимуляции, напротив, были существенно снижены у большинства больных, что свидетельствует об истощении у них резервных способностей нейтрофилов.
При изучении интерферонового статуса пациентов в период обострения ВПГ-инфекции выявлены различия при легком и тяжелом течении болезни. Так, уровень сывороточного ИФН у пациентов с легким течением заболевания был повышен в 2 раза по сравнению с группой контроля (р
- Хахалин Л. Н. Вирусы простого герпеса у человека// Consilium Medicum. 1999. Т. 1. № 1. С. 5–18.
- Европейские стандарты диагностики и лечения заболеваний, передаваемых половым путем. М.: Медицинская литература, 2003. С. 102–110.
- Малашенкова И. К., Дидковский Н. А. Принципы иммунокорригирующей терапии вторичных иммунодефицитов, ассоциированных с хронической вирусно-бактериальной инфекцией// Русский медицинский журнал. 2002. Т. 10. № 21. С. 973–977.
- Малашенкова И. К., Дидковский Н. А., Танасова А. Н., Щепеткова И. Н., Левко А. А. Принципы терапии герпесвирусной инфекции// Доктор.Ру. 2004. № 4. С. 26–30.
- Малашенкова И. К., Дидковский Н. А., Левко А. А. К вопросу о роли индивидуального подбора иммунокорректоров// Фарматека. 2004. С. 118–122.
- Левко А. А. Значение индивидуального подбора иммунокорректоров в комплексной терапии хронического рецидивирующего простатита, вызванного урогенитальной инфекцией: автореф. дис. . канд. мед. наук. М., 2005.
- Шульженко А. Е., Викулов Г. Х., Тутушкина Т. В. Герпетические инфекции — настоящее и будущее// Трудный пациент. 2003. № 4. Т. 1. С. 6–15.
Н. А. Дидковский, доктор медицинских наук, профессор
И. К. Малашенкова, кандидат медицинских наук
Ж. Ш. Сарсания, кандидат биологических наук
А. Н. Танасова, И. Н. Зуйкова, И. А. Зуйков, Н. М. Хитрик
НИИ физико-химической медицины, ММА им. И. М. Сеченова, Москва
Источник







