- Нахождение молекулярной формулы вещества (часть С)
- Теория к заданию 35 из ЕГЭ по химии
- Нахождение молекулярной формулы вещества
- Нахождение химической формулы вещества по массовым долям элементов
- Нахождение химической формулы вещества по массовым долям элементов, если указана плотность или относительная плотность данного вещества в газообразном состоянии
- Нахождение химической формулы вещества по данным об исходном веществе и о продуктах его сгорания (по уравнению химической реакции)
- Формула оксидов.
- Классификация оксидов.
- Как вывести химическую формулу оксида
- Написание формулы по валентности
- Составление формулы оксидов по валентности элементов
- Составление формулы оснований
- Составление формулы солей
- Составление формулы кислот
- Определение валентности по готовой формуле
Нахождение молекулярной формулы вещества (часть С)
Теория к заданию 35 из ЕГЭ по химии
Нахождение молекулярной формулы вещества
Нахождение химической формулы вещества по массовым долям элементов
Массовая доля элемента — это отношение его массы к общей массе вещества, в состав которого он входит:
Массовая доля элемента ($W$) выражается в долях единицы или в процентах.
Задача 1. Элементарный состав вещества следующий: массовая доля железа $72.41%$, массовая доля кислорода $27.59%$. Выведите химическую формулу.
1. Для расчетов выбираем массу оксида $m$(оксида)$=100$ г. Тогда массы железа и кислорода будут следующими:
2. Количества вещества железа и кислорода равны соответственно:
3. Находим соотношение количества веществ железа и кислорода:
$ν(Fe) : ν(O)=1.29 : 1.72.$
Меньшее число принимаем за $1 (1.29=1)$ и находим:
4. Так как в формуле должно быть целое число атомов, то это отношение приводим к целым числам:
$Fe : O=1 : 1.33=2 : 2.66=3·3.99=3 : 4$.
5. Подставляем найденные числа и получаем формулу оксида:
$Fe : O=3 : 4$, т. е. формула вещества $Fe_3O_4$.
Нахождение химической формулы вещества по массовым долям элементов, если указана плотность или относительная плотность данного вещества в газообразном состоянии
Задача 2. Массовая доля углерода в углеводороде составляет $80 %$. Относительная плотность углеводорода по водороду составляет $15$.
1. Обозначим формулу вещества $C_
2. Найдем число молей атомов углерода и водорода в $100$ г данного соединения:
3. Отношение между атомами:
$x : y=6.6 : 20=1 : 3$, или $2 : 6$.
Простейшая формула вещества $CH_3$.
4. Определяем молекулярную массу углеводорода по относительной плотности ее паров.
5. Вычисляем относительную молекулярную массу углеводорода по простейшей формуле:
6. Значения $M_x$ и $M_r$ не совпадают, $M_r=<1>/<2>M_x$, следовательно, формула углеводорода $C_2H_6$.
Ответ: молекулярная формула углеводорода $C_2H_6$ — этан.
3. Отношение между атомами:
5. Молярная масса может быть представлена в виде:
$M_r(C_xH_y)=A_r(C)_x+A_r(H)_y; M_r(C_xH_y)=12x+y$ или $30=12x+1y$.
6. Решаем систему двух уравнений с двумя неизвестными:
Ответ: формула $C_2H_6$ — этан.
Нахождение химической формулы вещества по данным об исходном веществе и о продуктах его сгорания (по уравнению химической реакции)
Задача 3. Найдите молекулярную формулу углеводорода, имеющего плотность $1.97$ г/л, если при сгорании $4.4$ г его в кислороде образуется $6.72$ л оксида углерода (IV) (н. у.) и $7.2$ г воды.
1. Напишем схему уравнения горения углеводорода
2. Вычисляем молярную массу $C_xH_y·M=ρ·V_m$,
$M=1.97$ г/л$·22.4$ л/моль$=44$ г/моль.
Относительная молекулярная масса $M_r=44$.
3. Определяем количество вещества:
4. Используя величину молярного объема, находим:
6. Следовательно: $ν(C_xH_y) : ν(CO_2) : νH_2O=0.1$ моль $: 0.3$ моль $: 0.4$ моль или $1 : 3 : 4$, что должно соответствовать коэффициентам в уравнении и позволяет установить число атомов углерода и водорода:
Окончательный вид уравнения:
Ответ: формула углеводорода $C_3H_8$ — пропан.
Источник
Формула оксидов.
Формула оксидов необходима для возможности решения задач и понимания возможных вариантов соединений химических элементов. Общая формула оксидов — ЭхОу. Кислород находится на втором месте после фтора по величине значение электроотрицательности, что является причиной того, что большинство соединений химических элементов с кислородом являются оксидами.
Классификация оксидов.
По классификации оксидов, солеобразующими оксидами являются те оксиды, которые могут взаимодействовать с кислотами либо основаниями с возможностью появления соответствующей соли и воды. Солеобразующими оксидами называют:
Основные оксиды, зачастую образующиеся из металлов со степенью окисления +1, +2. Могут реагировать с кислотами, с кислотными оксидами, с амфотерными оксидами, с водой (только оксиды щелочных и щелочно-земельных металлов). Элемент основного оксида становится катионом в образующейся соли. Na2O, CaO, MgO, CuO.
- Основный оксид + сильная кислота → соль + вода: CuO + H2SO4 → CuSO4 + H2O
- Сильноосновный оксид + вода → гидроксид: CaO + H2O → Ca(OH)2
- Сильноосновный оксид + кислотный оксид → соль: CaO + Mn2O7 → Ca(MnO4)2
- Основный оксид + водород → металл + вода: CuO + H2 → Cu + H2O
Примечание: металл менее активный, чем алюминий.
Кислотные оксиды – оксиды неметаллов и металлов в степени окисления +5 — +7. Могут реагировать с водой, щелочами, основными оксидами, амфотерными оксидами. Элемент кислотного оксида входит в состав аниона образующейся соли. Mn2O7, CrO3, SO3, N2O5.
- Кислотный оксид + вода → кислота: SO3 + H2O → H2SO4. Некоторые оксиды, к примеру SiO2, не могут вступать в реакцию с водой, поэтому их кислоты получают не прямым путём.
- Кислотный оксид + основный оксид → соль: CO2 + CaO → CaCO3
- Кислотный оксид + основание → соль + вода: SO2 + 2NaOH → Na2SO3 + H2O. Если кислотный оксид является ангидридом многоосновной кислоты, возможно образование кислых или средних солей: Ca(OH)2 + CO2 → CaCO3 ↓ + H2O, CaCO3 + H2O + CO2 → Ca(HCO3)2
- Нелетучий оксид + соль 1 → соль 2 + летучий оксид: SiO2 + Na2CO3 → Na2SiO3 + CO2
- Ангидрид кислоты 1 + безводная кислородосодержащая кислота 2 → Ангидрид кислоты 2 + безводная кислородосодержащая кислота 1: 2P2O5 + 4HClO4 → 4HPO3 + 2Cl2O7
Амфотерные оксиды, образуют металлы со степенью окисления от +3 до +5 (к амфотерным оксидам относятся также BeO, ZnO, PbO, SnO). Реагируют с кислотами, щелочами, кислотными и основными оксидами.
При взаимодействии с сильной кислотой или кислотным оксидом проявляют основные свойства: ZnO + 2HCl → ZnCl2 + H2O
При взаимодействии с сильным основанием или основным оксидом проявляют кислотные свойства:
Несолеобразующие оксиды не вступают в реакцию ни с кислотами, ни с основаниями, а значит, солей не образуют. N2O, NO, CO, SiO.
В соответствии с номенклатурой ИЮПАК, названия оксидов складываются из слова оксид и названия второго химического элемента (с меньшей электроотрицательностью) в родительном падеже:
Если элемент может образовывать несколько оксидов, то в их названиях следует указать степень окисления элемента:
Можно использовать латинские приставки для обозначения числа атомов элементов, которые входят в молекулу оксида:
- Na2O – оксид динатрия;
- CO – монооксид углерода;
- СО2 – диоксид углерода.
Часто используются также тривиальные названия некоторых оксидов:
Источник
Как вывести химическую формулу оксида
I . Вывод формул веществ по массовым долям элементов.
Массовая доля азота в оксиде азота равна 36,84 % . Найти формулу данного оксида.
Установите формулу неорганического соединения, содержащего 20 % магния, 53,33 % кислорода и 26,67 % некоторого элемента.
Массовая доля углерода в углеводороде равна 83,72 %. Найти молекулярную формулу углеводорода.
Массовая доля фосфора в его оксиде равна 43,66 %. Какова формула оксида?
Определить формулу вторичного амина, массовые доли углерода, водорода и азота, в котором составляют 61; 15,3 и 23,7 % соответственно.
Массовая доля углерода в диеновом углеводороде составляет 88,89 %. Найти молекулярную формулу диена.
II . Вывод формул веществ по массовым долям элементов и данным для нахождения истинной молярной массы (плотности, массе и объёму газа или относительной плотности).
Найти формулу углеводорода, в котором содержится 14,29 % водорода, а его относительная плотность по азоту равна 2.
Массовая доля углерода в углеводороде – 87,5 %, а относительная плотность углеводорода по воздуху равна 3,31. Определить формулу вещества.
Определить молекулярную формулу амина, массовые доли углерода, азота и водорода в котором составляют 38,7; 45,15 и 16,15 % соответственно. Относитель-
ная плотность его паров по воздуху равна 1,069.
Определите формулу углеводорода, массовая доля водорода в котором составляет 14,3 %. Относительная плотность этого вещества по водороду равна 21.
Относительная плотность паров углеводорода по воздуху равна 3,31, а массовая доля водорода в нём равна 12,5 %. Определите молекулярную формулу углеводорода.
III . Вывод формул веществ по продуктам сгорания.
При сгорании 7,2 г вещества образовалось 9,9 г углекислого газа и 8,1 г воды. Плотность паров этого вещества по водороду равна 16. Определите молекулярную формулу вещества.
При сгорании газа, не содержащего кислород, выделилось 2,24 л углекислого газа, 1,8 г воды и 3,65 г хлороводорода. Определить формулу сгоревшего вещества.
При сгорании вторичного амина симметричного строения выделилось 0,896 л (н.у.) углекислого газа, 0,99 г воды и 0,112 л (н.у.) азота. Установите молекулярную формулу этого амина.
При полном сгорании органического вещества, не содержащего кислород, выделилось 4,48 л (н.у.) углекислого газа, 1.8 г воды и 4 г фтороводорода. Установите молекулярную формулу сгоревшего соединения.
При сгорании 0,62 г газообразного органического вещества выделилось 0,448 л углекислого газа, 0,9 г воды и 0.224 л азота (объёмы газов измерены при н. у.). Плотность вещества по водороду 15,50. Установите его молекулярную формулу.
IV . Вывод формул органических веществ по общим формулам.
1. Вывод формул по известной массовой доле элемента в веществе.
Определить формулу аминокислоты, если известно, что она содержит 15,73 % азота.
Массовая доля водорода в алкане составляет 0,1579. Найти формулу алкана.
Массовая доля углерода в алкине 87,8 %. Определить формулу алкина.
Массовая доля кислорода в аминокислоте равна 35,95 %. Найти молекулярную формулу аминокислот.
Массовая доля хлора в монохлоралкане равна 55,04 %. Найти формулу моно —
2. Вывод формул по известным данным для нахождения истинной молярной массы
Пары одного из монобромалканов в 68,5 раз тяжелее водорода. Найти формулу монобромалкана.
Плотность газообразного алкина равна 2,41 г/л. Найти его молекулярную формулу.
Относительная плотность паров альдегида по воздуху равна 1,517. Найти его молекулярную формулу.
Относительная плотность паров первичного амина по кислороду – 2,719.
Определить его молекулярную формулу.
Найти молекулярную формулу алкина, если 5,6 л его имеют массу 10 г.
3. Вывод формул по уравнениям реакций в общем виде, если известны данные для двух веществ .
При взаимодействии предельного одноатомного спирта массой 3 г с избытком натрия было получено 0,56 л водорода. Определить формулу спирта.
При взаимодействии 2,9г неизвестного альдегида с аммиачным раствором оксида серебра получается 10,8г металла. Определить формулу альдегида.
В результате реакции предельного одноатомного спирта с 18,25г хлороводорода получили органический продукт массой 46,25г и воду. Определить молекулярную формулу спирта.
Для сжигания 5,8г алкана потребовалось 14,56л (н.у.) кислорода. Определить формулу алкана.
К 10,5г алкена присоединяют 5,6л бромоводорода (н.у.).
Найти формулу алкена.
4. Вывод формул по уравнениям реакций в общем виде с применением закона сохранения массы веществ.
Некоторый сложный эфир массой 7,4г подвергнут щелочному гидролизу. При этом получено 9,8г калиевой соли предельной одноосновной кислоты и 3.2г спирта. Установите формулу этого эфира.
При щелочном гидролизе 37г некоторого сложного эфира получено 49г калиевой соли предельной одноосновной кислоты и 16г спирта. Установить формулу сложного эфира.
Некоторая предельная одноосновная кислота массой 6г прореагировала с 6г спирта, при этом получилось 10,2г сложного эфира. Определить формулу кислоты.
Источник
Написание формулы по валентности
Валентность — способность атома присоединять то или иное число других атомов с образованием химической связи (см. «Что такое валентность»).
Для того, чтобы выводить химические формулы веществ по валентности элементов, необходимо знать, как минимум, валентности наиболее часто встречающихся элементов.
Алгоритм написания химической формулы вещества по валентности элементов, входящих в него:
- записать химические знаки элементов, входящих в вещество;
- определить валентность этих элементов;
- найти наименьшее общее кратное для валентностей этих элементов;
- определить индексы для атомов.
Составление формулы оксидов по валентности элементов
В качестве примера составим формулу оксида железа (III).
- В оксид железа входят железо и кислород: Fe O;
- Указываем валентность этих элементов: Fe III O II ;
- Находим наименьшее общее кратное (НОК): 3·2=6;
- Делим НОК на число единиц валентности каждого элемента:
- для Fe — 6:3=2;
- для O — 6:2=3.
- Записываем полученные индексы справа внизу от элемента: Fe2O3.
Составление формулы оснований
Важный нюанс, который неободимо знать — группы атомов могут рассматриваться, как единое целое.
Составление формул оснований по валентности элементов отличается от составления формулы оксидов лишь тем, что вместо атома кислорода в формуле стоит гидроксогруппа OH. В случае, если гидроксогруппа в формуле повторяется несколько раз, она берется в скобки.
В качестве примера составим составим формулу гидроксида магния.
На первом месте в основаниях стоит атом металла, гидроксогруппа — на втором.
Составление формулы солей
В солях «роль» гидроксогруппы OH играют кислотные остатки.
На первом месте в формуле средней соли стоит атом(ы) металла, кислотный остаток — на втором.
В качестве примера составим формулу соли фосфата натрия.
Составление формулы кислот
На первом месте в формуле кислот стоит атом(ы) водорода, кислотный остаток — на втором.
В качестве примера составим формулу серной кислоты.
Потренируемся в решении обратной задачи, когда по готовой формуле надо определить валентность элементов.
Определение валентности по готовой формуле
«Фишка» решения подобных задач заключается в том, что некоторые химические элементы в любых соединениях, в которые они входят, имеют постоянную валентность.
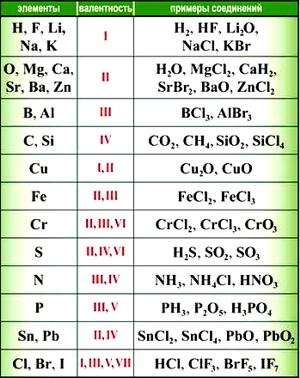
Элементы с постоянной валентностью:
- валентность I: H, F, Li, Na, K, Rb, Cs
- валентность II: O, Mg, Ca, Sr, Ba, Zn
- валентность III: Al
Большинство элементов в различных соединениях могут принимать различную валентность,, т. е., образовывать различное число химических связей.
Для нахождения валентности элементов с переменной валентностью в том или ином соединении используют правило валентности.
| x·m=y·n |
| в бинарных соединениях типа AmBn произведение валнетности элемента A(x) на кол-во его атомов m равно произведению валентности элемента B(y) на число его атомов n |
Определим, используя правило валентности, валентность фософра в соединении P2O5.
Поскольку валентность кислорода равна II, то:
Теперь решим ту же задачу, используя алгоритм, описанный выше для выведения формулы по валентности, который будем применять «сзади-наперёд».
Определим валентность фосфора и кислорода в соединении P2O5.
- P2O5
- валентность кислорода равна двум: P2O5 II
- общее число единиц валентности всех атомов вещества будет равно 2·5=10
- делим общее число единиц валентности (10) на индекс кислорода, валентность которого известна: 10:2=5 — это и будет валентность неизвестного, в нашем случае, фосфора
- P2 V O5 II
Немного усложним задачу и определим валентность элементов в соли кислородсодержащей кислоты Al2(SO4)3.
- решение задачи начинается с элемента с известной валентностью, т. е., с кислорода — определяем кол-во его атомов: 4·3=12
- с учётом того, что валентность кислорода равна 2, находим общее число единиц валентности для кислорода: 12·2=24
- по аналогии вычисляем общее число единиц валентности для атомов алюминия (валентность=3): 2·3=6
- от общего числа единиц валентности кислорода вычитаем общее число единиц валентности алюминия: 24-6=18 — это общее число единиц валентности, которое будет приходиться на серу
- по аналогии с кислородом определяем число атомов серы, валентность которой неизвестна: 1·3=3
- чтобы узнать валентность серы следует разделить разность, найденную в п.4, на число атомов серы: 18:3=6
- Al2 III (S VI O4 II )3
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Источник