- Изотермический процесс
- Что такое изотермический процесс
- Закон Бойля-Мариотта
- Готовые работы на аналогичную тему
- Какой процесс называется изотермическим
- Что такое изотермический процесс
- Закон Бойля-Мариотта
- Как изменяется внутренняя энергия при изотермическом процессе
- Формула количества теплоты в изотермическом процессе
- Блог об энергетике
- энергетика простыми словами
- Основные термодинамические процессы
- Изохорный процесс
- Изобарный процесс
- Изотермический процесс
- Адиабатный процесс
- Политропный процесс
- Что такое изотермический процесс? (Примеры, упражнения)
- Содержание:
- Примеры изотермических процессов
- Цикл Карно
- Расчет работы, проделанной в изотермическом процессе
- — Упражнение 1
- Решение
- — Упражнение 2.
- Решение
Изотермический процесс
Вы будете перенаправлены на Автор24
Что такое изотермический процесс
Изотермическим процессом называется процесс, происходящий в неизменной массе газа при постоянной температуре.
\[p_1V_1=\nu RT\left(1\right),\] \[p_2V_2=\nu RT\ \left(2\right).\]
Закон Бойля-Мариотта
Разделим уравнение (2) на уравнение (1), получим уравнение изотермического процесса:
Уравнение (4) называют законом Бойля-Мариотта.
Этот процесс происходит с подводом тепла, если объем увеличивается, или его отводом, чтобы уменьшать объем. Запишем первое начало термодинамики, последовательно получим выражения для работы, внутренней энергии и количества теплоты изотермического процесса:
\[\delta Q=dU+dA=\frac<2>\nu RdT+pdV,\ \left(5\right).\]
Температура не изменяется, следовательно, изменение внутренней энергии равно нулю ($dU=0$). Получается, что в изотермическом процессе все подводимое тепло идет на совершение газом работы:
где $\delta Q\ $- элементарное тепло, подводимое к системе, $dA$- элементарная работа, которую совершает газ в процессе, i — число степеней свободы молекулы газа, R — универсальная газовая постоянная, d -количество молей газа, $V_1$- начальный объем газа, $V_2$- конечный объем газа.
Используем уравнение состояния идеального газа, выразим из него давление:
Подставим уравнение (8) в подынтегральное выражение уравнения (7):
Уравнение (9) — выражение для работы газа в изотермическом процессе. Уравнение (9) можно записать через отношение давлений, если использовать закон Бойля-Мариотта, в таком случае:
\[A=\nu RTln\left(\frac
Уравнение (11) определяет количество теплоты, сообщаемое газу массы m в изотермическом процессе$.
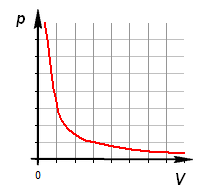
Изопроцессы очень часто изображают на термодинамических диаграммах. Так, линия, изображающая на такой диаграмме изотермический процесс, называется изотермой (рис.1).
Задание: Идеальный одноатомный газ расширяется при постоянной температуре от объема $V_1=0,2\ м^3$ до $V_2=0,6\ м^3$. Давление в состоянии 2 равно $p_2=1\cdot <10>^5\ Па$. Определить:
- Изменение внутренней энергии газа.
- Работу, которую совершает газ в этом процессе.
- Количество теплоты, получаемое газом.
Так как процесс изотермический, то внутренняя энергия газа не изменяется:
Из первого начала термодинамики, следовательно:
\[\triangle Q=A\ \left(1.1\right).\] \[A=\nu RTln\left(\frac
Запишем уравнение конечного состояния идеального газа:
Подставим выражение для температуры из (1.3) в (1.2), получим:
Так как все величины в данных находятся в СИ, проведем расчет:
Ответ: Изменение внутренней энергии газа в заданном процессе равно нулю. Работа, которую совершает газ в этом процессе $6,6<\cdot 10>^4Дж.$ Количество теплоты, получаемое газом в данном процессе, $6,6<\cdot 10>^4Дж$.
Готовые работы на аналогичную тему
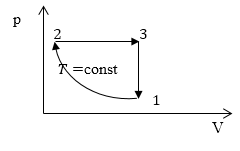
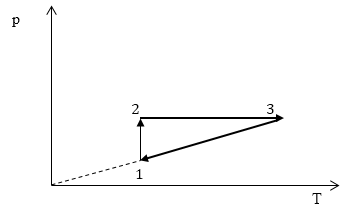
Задание: На рис 2. представлен график изменения состояния идеального газа массы m в осях p(V). Перенесите этот процесс в оси p(T).
Опишем данный на рисунке 2 круговой процесс.
1-2 изотермический процесс ($T=$const), в котором объем уменьшается (V$\downarrow $), давление растет (p$\uparrow $).
2-3 изобарический процесс ($p=$const), в котором V$\uparrow $, следовательно, из закона Гей-Люссака, T$\uparrow .$
3-1 изохорный процесс (V$=const$), в нем p$\downarrow $, следовательно, из закона Шарля T$\downarrow $.
Изобразим в осях p(T) вышеперечисленные процессы.
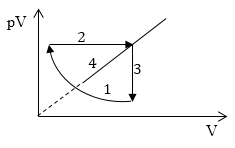
Задание: Какой график на рис. 4 представляет изотермический процесс?
Изотермический процесс описывается законом Бойля-Мариотта
Следовательно, на графике в осях $pV(V)$ изотерма представлена графиком 2.
Источник
Какой процесс называется изотермическим
Что такое изотермический процесс
Изотермический процесс – процесс изменения состояния идеального газа при постоянной температуре.
Главное условие: T=const
С разницей в 14 лет закон открыли Роберт Бойль (1662 г.) и Эдм Мариотт (1676 г.) Название дано в честь обоих ученых.
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут.
Закон Бойля-Мариотта
При постоянной температуре и массе идеального газа произведение его давления и объёма постоянно.
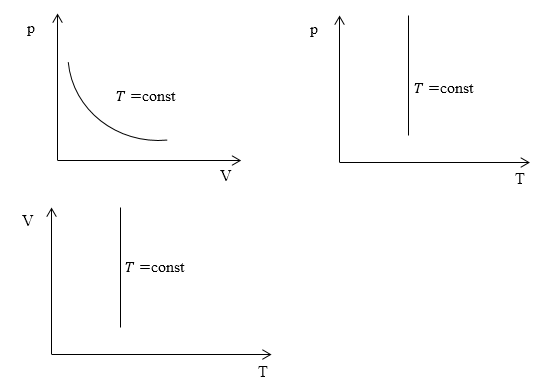
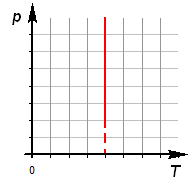
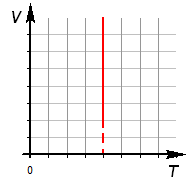
Закон выражается графиками:
1. Зависимость давления от объема:
2. Зависимость давления от температуры:
3. Зависимость объема от температуры:
Как изменяется внутренняя энергия при изотермическом процессе
Внутренняя энергия изменяется вместе с температурой. Отличительной чертой изотермического процесса является его протекание с постоянной температурой. Из этого следует, что внутренняя энергия не изменяется.
Формула количества теплоты в изотермическом процессе
Запишем первый закон термодинамики:
Поскольку температура постоянна, то изменение внутренней энергии равно нулю. Уравнение принимает вид:
Источник
Блог об энергетике
энергетика простыми словами
Основные термодинамические процессы
Основными процессами в термодинамике являются:
- изохорный, протекающий при постоянном объеме;
- изобарный, протекающий при постоянном давлении;
- изотермический, происходящий при постоянной температуре;
- адиабатный, при котором теплообмен с окружающей средой отсутствует;
- политропный, удовлетворяющий уравнению pv n = const.
Изохорный, изобарный, изотермический и адиабатный процессы являются частными случаями политропного процесса.
При исследовании термодинамических процессов определяют:
- уравнение процесса в p—v иT—s координатах;
- связь между параметрами состояния газа;
- изменение внутренней энергии;
- величину внешней работы;
- количество подведенной теплоты на осуществление процесса или количество отведенной теплоты.
Изохорный процесс

При изохорном процессе выполняется условие v = const.
Из уравнения состояния идеального газа (pv = RT) следует:
т. е. давление газа прямо пропорционально его абсолютной температуре:
Работа расширения в изохорном процессе равна нулю (l = 0), так как объем рабочего тела не меняется (Δv = const).
Количество теплоты, подведенной к рабочему телу в процессе 1-2 при cv = const определяется по формуле:
Т. к.l = 0, то на основании первого закона термодинамики Δu = q, а значит изменение внутренней энергии можно определить по формуле:
Изменение энтропии в изохорном процессе определяется по формуле:
Изобарный процесс
Изобарным называется процесс, протекающий при постоянном давлении p = const. Из уравнения состояния идеального газа слуедует:
т. е. в изобарном процессе объем газа пропорционален его абсолютной температуре.
Работа будет равна:
Количество теплоты при cp = const определяется по формуле:
Изменение энтропии будет равно:
Изотермический процесс
При изотермическом процессе температура рабочего тела остается постоянной T = const, следовательно:
т. е. давление и объем обратно пропорциональны друг другу, так что при изотермическом сжатии давление газа возрастает, а при расширении – снижается.
Работа процесса будет равна:
Так как температура остается неизменной, то и внутренняя энергия идеального газа в изотермическом процессе остается постоянной (Δu = 0) и вся подводимая к рабочему телу теплота полностью превращается в работу расширения:
При изотермическом сжатии от рабочего тела отводится теплота в количестве, равном затраченной на сжатие работе.
Изменение энтропии равно:
Адиабатный процесс
Адиабатным называется процесс изменения состояния газа, который происзодит без теплообмена с окружающей средой. Так как dq = 0, то уравнение первого закона термодинамики для адиабатного процесса будет иметь вид:
В адиабатном процессе работа расширения совершается только за счет расходования внутренней энергии газа, а при сжатии, происходящем за счет действия внешних сил, вся совершаемая ими работа идет на увеличение внутренней энергии газа.
Обозначим теплоемкость в адиабатном процессе через cад, и условие dq = 0 выразим следующим образом:
Это условие говорит о том, что теплоемкость в адиабатном процессе равна нулю (cад = 0).
и уравнение кривой адиабатного процесса (адиабаты) в p, v-диаграмме имеет вид:
В этом выражении k носит название показателя адиабаты (так же ее называют коэффициентом Пуассона).
kвыхлопных газов ДВС = 1,33
Из предыдущих формул следует:
Техническая работа адиабатного процесса (lтехн) равна разности энтальпий начала и конца процесса (i1 – i2).
Адиабатный процесс, происходящий без внутреннего трения в рабочем теле, называется изоэнтропийным. В T, s-диаграмме он изображается вертикальной линией.
Обычно реальные адиабатные процессы протекают при наличии внутреннего трения в рабочем теле, в результате чего всегда выделяется теплота, которая сообщается самому рабочему телу. В таком случае ds > 0, и процесс называется реальным адиабатным процессом.
Политропный процесс
Политропным называется процесс, который описывается уравнением:
Показатель политропы n может принимать любые значения в пределах от -∞ до +∞, но для данного процесса он является постоянной величиной.
Из уравнения политропного процесса и уравнения Клайперона можно получить выражение, устанавливающее связь между p, vи Tв любых двух точках на политропе:
Работа расширения газа в политропном процессе равна:
В случае идеального газа эту формулу можно преобразовать:
Количество подведенной или отведенной в процессе теплоты определяется с помощью первого закона термодинамики:
представляет собой теплоемкость идеального газа в политропном процессе.
При cv, k и n = const cn = const, поэтому политропный процесс иногда определят как процесс с постоянной теплоемкостью.
Политропный процесс имеет обобщающее значение, ибо охватывает всю совокупность основных термодинамических процессов.
Графическое представление политропа в p, v координатах в зависимости от показателя политропа n.
pv 0 = const (n = 0) – изобара;
pv = const (n = 1) – изотерма;
p 0 v = const, p 1/∞ v = const, pv ∞ = const – изохора;
n > 0 – гиперболические кривые,
n По материалам моего конспекта лекций по термодинамике и учебника «Основы энергетики». Автор Г. Ф. Быстрицкий. 2-е изд., испр. и доп. — М. :КНОРУС, 2011. — 352 с.
Источник
Что такое изотермический процесс? (Примеры, упражнения)
Содержание:
В изотермический процесс или изотермический — это обратимый термодинамический процесс, при котором температура остается постоянной. В газе бывают ситуации, когда изменение в системе не приводит к изменению температуры, а вызывает изменение физических характеристик.
Эти изменения представляют собой фазовые переходы, когда вещество переходит из твердого состояния в жидкое, из жидкого в газообразное или наоборот. В таких случаях молекулы вещества меняют свое положение, добавляя или извлекая тепловую энергию.
Тепловая энергия, необходимая для возникновения фазового перехода в веществе, называется скрытой теплотой или теплотой превращения.
Один из способов сделать процесс изотермическим — это поместить вещество, которое будет изучаемой системой, в контакт с внешним тепловым резервуаром, который представляет собой другую систему с большой теплотворной способностью. Таким образом происходит настолько медленный теплообмен, что температура остается постоянной.
Этот тип процесса часто встречается в природе. Например, у людей, когда температура тела повышается или понижается, мы чувствуем себя больными, потому что в нашем теле многие химические реакции, поддерживающие жизнь, происходят при постоянной температуре. Это справедливо для теплокровных животных в целом.
Другие примеры — лед, который тает от жары, когда приходит весна, и кубики льда, которые охлаждают напиток.
Примеры изотермических процессов
— Обмен веществ у теплокровных животных осуществляется при постоянной температуре.
— Когда вода закипает, происходит фазовый переход от жидкости к газу, а температура остается постоянной примерно на уровне 100 º C, поскольку на значение могут влиять другие факторы.
-Таяние льда — еще один распространенный изотермический процесс, так же как и помещение воды в морозильную камеру для изготовления кубиков льда.
-Автомобильные двигатели, холодильники, а также многие другие виды техники исправно работают в определенном температурном диапазоне. Для поддержания нужной температуры устройства называли термостаты. В его конструкции использованы различные принципы работы.
Цикл Карно
Двигатель Карно — идеальная машина, работа которой достигается благодаря полностью обратимым процессам. Это идеальная машина, потому что она не учитывает процессы, рассеивающие энергию, такие как вязкость вещества, выполняющего работу, или трение.
Цикл Карно состоит из четырех стадий, две из которых точно изотермические, а две другие адиабатические. Изотермические стадии — это сжатие и расширение газа, который производит полезную работу.
Двигатель автомобиля работает по аналогичным принципам. Движение поршня внутри цилиндра передается другим частям автомобиля и вызывает движение. Он не имеет поведения идеальной системы, такой как двигатель Карно, но термодинамические принципы являются общими.
Расчет работы, проделанной в изотермическом процессе
Чтобы рассчитать работу, совершаемую системой при постоянной температуре, мы должны использовать первый закон термодинамики, который гласит:
Это еще один способ выражения сохранения энергии в системе, представленный через ΔU или изменение энергии, Q по мере поступления тепла и, наконец, W, что и есть работа, проделанная указанной системой.
Предположим, что рассматриваемая система представляет собой идеальный газ, содержащийся в цилиндре подвижного поршня площадью К, который работает, когда его объем V смена V1 к V2.
Уравнение состояния идеального газа: PV = nRT, которая связывает объем с давлением п и температура Т. Значения n и R постоянны: n — количество молей газа, а R — постоянная газов. В случае изотермического процесса продукт PV это постоянно.
Итак, проделанная работа рассчитывается путем интегрирования небольшой дифференциальной работы, в которой сила F производит небольшое смещение dx:
Как Adx это именно изменение объема dV, так:
Чтобы получить полную работу в изотермическом процессе, проинтегрируем выражение для dW:
Давление п и объем V изображены на диаграмме P-V как показано на рисунке, а проделанная работа равна площади под кривой:
Как ΔU = 0 поскольку температура остается постоянной, в изотермическом процессе необходимо:
— Упражнение 1
Цилиндр с подвижным поршнем содержит идеальный газ при 127ºC. Если поршень движется, чтобы уменьшить начальный объем в 10 раз, сохраняя постоянную температуру, найдите количество молей газа, содержащегося в цилиндре, если работа, проделанная с газом, равна 38 180 Дж.
Факт: R = 8,3 Дж / моль. K
Решение
В заявлении говорится, что температура остается постоянной, поэтому мы находимся в наличии изотермического процесса. Для работы, проделанной с газом, мы имеем ранее выведенное уравнение:
127 º C = 127 + 273 K = 400 K
Решите относительно n количество родинок:
n = W / RT ln (V2 / V1) = -38 180 Дж / 8,3 Дж / моль K x 400 K x ln (V2/ 10 В2) = 5 моль
Работе предшествовал отрицательный знак. Внимательный читатель заметит в предыдущем разделе, что W было определено как «работа, выполняемая системой» и имеет знак +. Так что «проделанная работа над системой» имеет отрицательный знак.
— Упражнение 2.
У вас есть воздух в цилиндре с поршнем. Изначально есть 0,4 м 3 газа под давлением 100 кПа и температурой 80ºC. Воздух сжимается до 0,1 м 3 обеспечение постоянной температуры внутри цилиндра во время процесса.
Определите, сколько работы было сделано во время этого процесса.
Решение
Мы используем ранее полученное уравнение для работы, но количество молей неизвестно, которое можно рассчитать с помощью уравнения идеального газа:
80 º C = 80 + 273 K = 353 K.
п1V1 = n.R.T → n = P1V1 / RT = 100000 Па x 0,4 м 3 /8,3 Дж / моль. K x 353 K = 13,65 моль
W = n.R.T ln (V2/ V1) = 13,65 моль x 8,3 Дж / моль. K x 353 K x ln (0,1 / 0,4) = -55,442,26 Дж
Опять же отрицательный знак указывает на то, что в системе были выполнены работы, что всегда происходит при сжатии газа.
Источник